Etanamidstruktur, egenskaper, bruksområder, effekter
- 1436
- 100
- Daniel Skuterud
De etanamid Det er et kjemikalie som tilhører gruppen av organiske nitrogenforbindelser. Det kalles også acetamid, ifølge International Union of Pure and Applied Chemistry (IUPAC). Kommersielt kalles eddiksyre.
Det kalles amida fordi nitrogen er knyttet til en karbonylgruppe. Det er primært, fordi det beholder de to hydrogenatomer forenet til nitrogen -NH2. Det har blitt funnet i naturen som mineral bare i tørr tid; I den regnfulle eller veldig fuktige sesongen løses den opp i vannet.
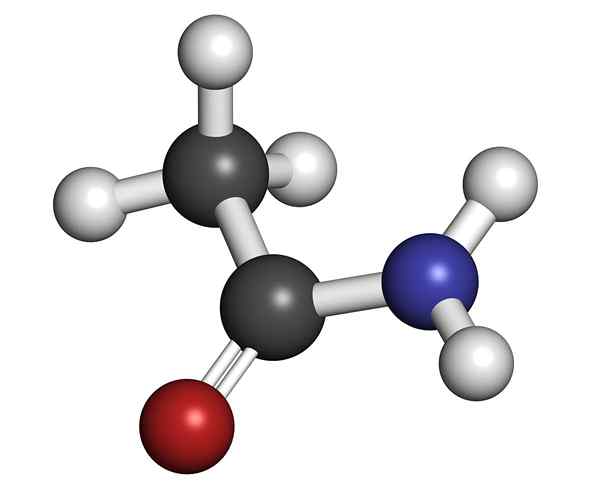
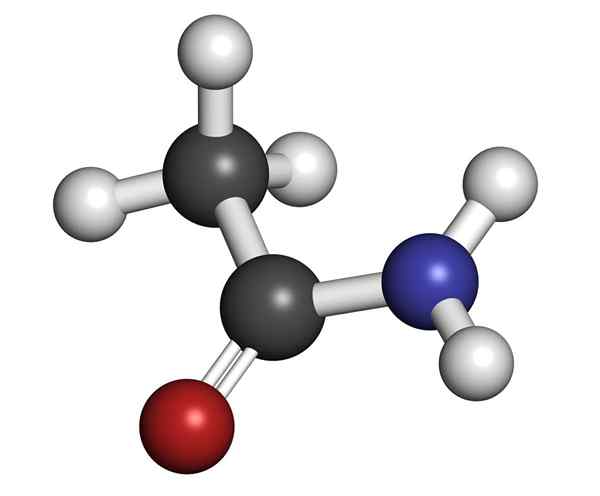 Molekylær struktur av acetamid
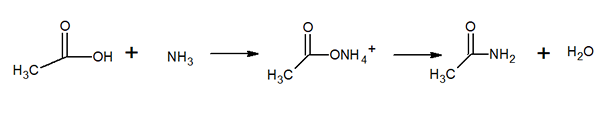
Molekylær struktur av acetamid Det er et glassaktig å se på solid (gjennomsiktig). Fargen går fra fargeløs til grå, danner små stalaktitter og noen ganger granulære aggregater. Det kan oppstå ved reaksjonen mellom eddiksyre og ammoniakk, og danne et mellomliggende salt: ammoniumacetat. Da er dette dehydrert for å produsere amida og danne vann:
[TOC]
Kjemisk struktur
Den indre kjemiske strukturen til acetamidkrystall.
Den strukturelle formelen til forbindelsen består av en acetylgruppe og en aminogruppe:
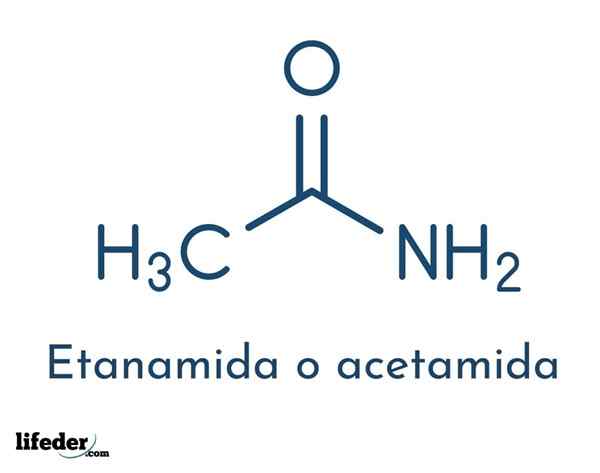
Disse gruppene tillater de forskjellige reaksjonene som forbindelsen kan utføres. Den molekylære formelen til acetamid er C2H5NEI.
Fysiske egenskaper til etanamid
Utseende | De er krystaller som spenner fra fargeløse til grå. |
Lukt | Toalett. Når han har urenheter, har han en lukt av ammoniakk-urea. |
Idé | Det kan finnes i naturen, i tillegg til gruvene i røttene til sukkerroer, i vinen som har oksidert i overkant, og i røyk av tobakk. |
Molmasse | 59.07 g/ml |
Vanntetthet | 1.159 g/cm³ |
Smeltepunkt | Mellom et område på 79 ° C-81 ° C |
Kokepunkt | 221 ° C |
Vannløselighet, etanol, pyridin, kloroform, glyserol og benzen | Veldig løselig |
Damptrykk | 1.3x10-5 atm. |
Kjemiske egenskaper
De kjemiske egenskapene til et stoff refererer til deres reaktivitet når de er i nærvær av andre som kan forårsake transformasjon til dets struktur. Acetamid presenterer følgende reaksjoner:
Kan tjene deg: Faraday konstantSyre og basisk hydrolyse
Ved syrehydrolyse reagerer den med uorganisk syre ved høy temperatur for å danne karboksylsyre og et ammoniumsalt.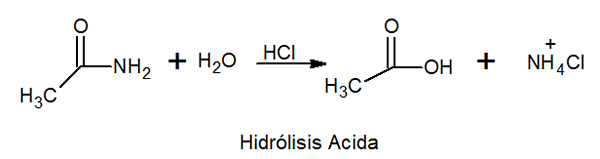
I basisk hydrolyse oppstår metall og ammoniakksalt.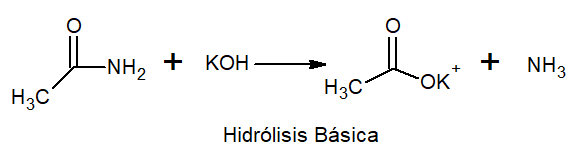
Reduksjon
Reduksjon betyr hydrogenforsterkning, så denne reaksjonen produserer en primær amin kalt etanamin eller etylamin. Reducer er litiumhydrid og aluminium Lialh4. 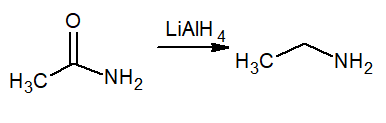
Dehydrering
Dette begrepet indikerer tap av vann fra molekylet. De brukes som dehydreringsreagenser tioniloklorid (SOCL2) eller fosforpentoksyd (P2ENTEN5). Sluttproduktet er en nitril. 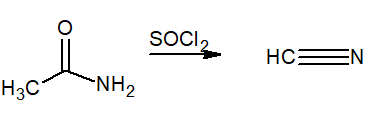
På det industrielle feltet er produksjonen av karboksylsyrer veldig fordelaktig på grunn av viktigheten av derivater. Å oppnå etansyre fra acetamid har imidlertid en veldig begrenset påføring, fordi de høye temperaturene som prosessen skjer har en tendens til å bryte ned syren.
I laboratoriet, selv om etanamid kan oppnås fra eddiksyre, er rekonversjonen av en syramid veldig usannsynlig, og dette er vanligvis for alle amider.
Det kan tjene deg: ititrium: struktur, egenskaper, bruk, innhentingAcetamidbruk
Acetamid har skjedd kommersielt siden 1920, selv om det ikke er sikkert at det hittil er i kommersiell bruk. Tidligere ble det brukt til syntese av metylamin, tioacetamid, hypnotika, insektmidler og for medisinske formål.
Acetamid er en forbindelse som i industrifeltet brukes som:
- Plaskisering, i lær, stofffilmer og belegg.
- Papirtilsetningsstoff, for å gi motstand og fleksibilitet.
- Alkohol denaturering. Det legges til alkoholen i studien for å fjerne en del av renheten den har, og kan dermed tjene andre bruksområder, for eksempel løsningsmiddel.
- Lakk, for å skinne til overflater og/eller for å beskytte materialene mot miljøgresjonene, spesielt korrosjon.
- Eksplosiv.
- Grunnlegger, siden det å bli lagt til et stoff, letter fusjonen av dette.
- I kryoskopi.
- As an intermediate in the elaboration of medications such as ampicillin and antibiotics derived from cephalosporins, such as: headache, cephalexin, heat, enalapril malleate (hypertension treatment) and sulfacetamide (antimicrobial ophthalmic drops), among others.
- Løsningsmiddel, siden noen stoffer øker løseligheten i vann når acetamid blir oppløst i det.
- Som et løsningsmiddel som fikser fargestoffene i tekstilindustrien.
- I utdyping av metylamin.
- Som et biocid, i forbindelser som kan brukes som desinfeksjonsmidler, konserveringsmidler, plantevernmidler, etc.
Helseeffekter
I kjemiske industrier der acetamid brukes som et løsningsmiddel og mykgjøring, kan arbeidere presentere hudirritasjon på grunn av akutt (kortvarig eksponering) ved tilstedeværelsen av disse forbindelsene.
Det er ingen informasjon om kroniske effekter (på lang sikt) eller kreftfremkallende utvikling hos mennesker. I følge USAs Environmental Protection Agency (EPA) er acetamid ikke klassifisert som kreftfremkallende.
Det kan tjene deg: Ingen elektrolytter: Kjennetegn og eksemplerDet internasjonale byrået for kreftforskning har klassifisert acetamid som en 2B -gruppe, mulig menneskelig kreftfremkallende.
California Environmental Protection Agency har opprettet et anslag for inhalasjonsrisiko på 2 × 10-5 µg/m3 (Mikrogram per kubikkmeter), og en risiko for kreft i munnen etter 7 × 10 inntak-2 mg/kg/d (milligramos for hvert kilo på en dag) i lang tid.
Selv om den generelle befolkningen kan bli utsatt for å røyke sigaretter eller hudkontakt med produkter som inneholder acetamid, representerer den ikke mye risiko på grunn av egenskapene til løselighet og hygroskopi som den har med vann.
Det kan lett flyttes av bakken gjennom avrenning, men det forventes å bli degradert av mikroorganismer og ikke akkumuleres i fisk.
Acetamid er en svak irriterende hud og øyne, og det er ingen tilgjengelige data som sertifiserer dens giftige effekter på mennesker.
Hos laboratoriedyr ble toksisitet observert i kroppsvekttap når det ble utsatt for en veldig høy oral dose over tid. Imidlertid ble det ikke observert noen aborter eller skadelige effekter ved fødselen av foreldrene som ble behandlet med acetamid.
Referanser
- Cosmos Online, (siden 1995), teknisk og kommersiell informasjon om acetamid, utvunnet 23. mars 2018, Cosmos.com.MX
- Morrison, r., Boyd, r., (1998), Organic Chemistry (5. utgave), Mexico, Inter -American Educational Fund, S.A de c.V
- Pine, s., Hammond, g., Cram, d., Hendrickson, J., (1982). Organic Chemistry, (Second Edition), Mexico, McGraw-Hill de México, S.A de c.V
- Chemical Guide, (2013), Bruk av acetamid, utvunnet 24. mars 2018, Guiadeproductosquimicos.Blogspot.com.co
- Nasjonalt senter for bioteknologiinformasjon. PubChem Compound Database; CID = 178, acetamid. Gjenopprettet pubchem.NCBI.NLM.NIH.Gov

