Litiumfluoridstruktur, egenskaper, innhenting, bruk

- 1228
- 253
- Daniel Skuterud
Han Litiumfluorid Det er et uorganisk fast stoff hvis kjemiske formel er LIF. Dannes av Li -ioner+ og f- som er forent gjennom et ionisk bånd. Det finnes i små mengder i flere mineraler, spesielt silikater som lepidolitt, sjøvann og i mange mineralbrønner.
Den har hatt bred bruk på optiske enheter på grunn av dens åpenhet i et bredt spekter av bølgelengder, fra det infrarøde spekteret (IR) til UV -ultrafiolett, gjennom det synlige.
 Lepidolite, mineral som inneholder små mengder livsfluorid. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Lepidolite, mineral som inneholder små mengder livsfluorid. Rob Lavinsky, Irocks.COM-CC-BY-SA-3.0 [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Det har også blitt brukt på enheter for å oppdage farlig stråling i jobber der folk blir utsatt for disse i kort tid. I tillegg brukes det som materiale for å smelte aluminium eller for å lage briller eller glass glass og keramisk produksjon.
Det fungerer som materiale for å dekke litium -ion -batteri -komponenter og for å forhindre det første tapet av belastning av disse.
[TOC]
Struktur
Litiumfluorid er en ionisk forbindelse, det vil si dannet av foreningen av liasjonen+ og anion f-. Kraften som holder dem sammen er elektrostatisk og kalles ionisk binding.
Når litium er kombinert, gir han et elektron til fluor, begge er mer stabilt enn den første måten, som forklart nedenfor.
Litiumelementet har følgende elektroniske konfigurasjon: [HE] 1S2 2s1 Og når du gir et elektron, er den elektroniske strukturen slik: [han] 1s2 som er mye mer stabil.
Fluorelementet hvis elektroniske konfigurasjon er: [ne] 1s2 2s2 2 s5, Ved å godta elektronet er skjemaet [NE] 1s2 2s2 2 s6, mer stabil.
Nomenklatur
- Litiumfluorid
- Fluorolitio
Kan tjene deg: ikke -metalliske oksider- Litiummonofluorid
Egenskaper
Fysisk tilstand
Hvitt fast stoff, som krystalliserer i kubisk struktur, for eksempel natriumklorid -NaCl.
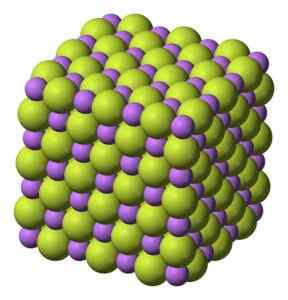 Kubisk struktur av liv litiumfluoridkrystaller. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Kubisk struktur av liv litiumfluoridkrystaller. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Molekylær vekt
26 g/mol
Smeltepunkt
848.2 ºC
Kokepunkt
1673 ºC, selv om det er flyktig ved 1100-1200 ºC
Tetthet
2.640 g/cm3
Brytningsindeks
1.3915
Løselighet
Lite oppløselig i vann: 0,27 g/100 g vann ved 18 ºC; 0,134 g/100 g ved 25 ºC. Løselig i surt medium. Uoppløselig i alkohol.
Andre egenskaper
Dirporene har dimiske arter (LIF)2 og trimerisk (LIF)3. Med HF fluorhorhoric acid form lihf litium2; Med litiumhydroksyd danner det et dobbelt Lif -salt.Lioh.
Innhenting og beliggenhet
LIF litiumfluorid kan oppnås ved reaksjon mellom HF -fluorhorsyre og Lioh litiumhydroksyd eller litiumlitiumkarbonat2Co3.
Imidlertid er det til stede i små mengder i visse mineraler som lepidolitt og sjøvann.
 Litiumfluor finnes i små mengder i sjøvann. Adeeb Atwan [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons.
Litiumfluor finnes i små mengder i sjøvann. Adeeb Atwan [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons. applikasjoner
I optiske applikasjoner
LIF brukes i form av kompakte krystaller i infrarøde spektrofotometre (IR) på grunn av den utmerkede spredningen de har i bølgelengdeintervallet mellom 4000 og 1600 cm-1.
LIF LIF -krystaller oppnås fra mettede løsninger fra dette saltet. Det kan erstatte naturlige fluorkrystaller i forskjellige typer optiske enheter.
Store og rene krystaller brukes i optiske systemer for ultrafiolett lys (UV), synlig og IR og røntgenmonokromatorer (0,03-0,38 nm).
 Life Lif Fluoruro Crystal, inne i et begerglass. V1adis1av [offentlig domene]. Kilde: Wikimedia Commons.
Life Lif Fluoruro Crystal, inne i et begerglass. V1adis1av [offentlig domene]. Kilde: Wikimedia Commons. Det brukes også som optisk beleggmateriale for UV -regionen på grunn av det brede optiske båndet, større enn for andre metallfluorider.
Det kan tjene deg: Alkalinderrous metallerHans åpenhet i det fjerne UV (90-200 nm) gjør det ideelt som et beskyttende belegg i aluminiumsspeil (AL). LIF/AL -speil har bruk i optiske teleskopsystemer for romapplikasjoner.
Disse beleggene oppnås ved fysisk avsetning av damp og lagavsetning på atomnivå.
I ioniserende eller farlige stråledetektorer
Litiumfluorid har blitt mye brukt i termoluminescerende detektorer for fotoner, nøytron og β (beta) stråling.
Termoluminescerende detektorer holder strålingsenergien når de blir utsatt for dette. Deretter slipper dem opp energien som er lagret i lysform.
For denne applikasjonen er LIF generelt datert med magnesium urenheter (MG) og Titanium (TI). Disse urenheter genererer visse energinivåer som fungerer som hull der elektronene som frigjøres ved stråling er fanget. Når materialet deretter varmet opp, går disse elektronene tilbake til sin opprinnelige energitilstand som slipper ut lys.
Intensiteten til det utsendte lyset avhenger direkte av energien som er absorbert av materialet.
Termoluminescerende detektorer av LIF er vellykket testet for å måle komplekse strålingsfelt, for eksempel de som er til stede i den store Hadron Collider, eller LHC (for dets forkortelse for engelsk Large Hadron Collider), som ligger i den europeiske organisasjonen for kjernefysisk forskning, kjent som CERN (for sin forkortelse av fransk Conseil Européen Hell Recherche Nucleaire).
Stråling i opplevelsene som ble utført i at forskningssenteret presenterer Hadrones, nøytroner og elektroner/positroner, blant andre typer subatomiske partikler, som alle kan oppdages med LIF.
Som materiale for å prelite litiumbatterikatoden
LIF er vellykket testet i form av nanokompositter med kobolt (CO) og jern (tro) som materialer for prelitiation (oversettelse av engelsk Prelithiation) av litium -ion -batterikatodematerialet.
Kan tjene deg: etyleterI løpet av den første belastningssyklusen eller formasjonsstadiet til et litiumionbatteri, brytes den organiske elektrolytten for å danne en fast fase på overflaten av anoden.
Denne prosessen bruker litium av katoden og reduserer energi mellom 5 til 20% av den totale kapasiteten til litiumionbatteriet.
Av denne grunn er den elektrokjemiske prelitering av katoden blitt undersøkt, som genererer en elektrokjemisk ekstraksjon av litium av nanokomponerte, som fungerer som en litiumdonor, og dermed unngår forbruket av litium av katoden.
Nanokompositter LIF/CO og LIF/FE har en høy kapasitet til å donere litium til katoden, og er lett å syntetisere, stabile i miljø- og batteribehandlingsforhold.
 Litium-ion-batteri. Forfatter: MR.ちゅら さん. Lithium_battery * Photography Day, August, 2005 * Photography Person Aney. Kilde: Wikimedia Commons.
Litium-ion-batteri. Forfatter: MR.ちゅら さん. Lithium_battery * Photography Day, August, 2005 * Photography Person Aney. Kilde: Wikimedia Commons. I flere bruksområder
Litiumfluor brukes som sveisemåler, spesielt aluminium, og i sveisestangbelegg. Det brukes også i aluminiumreduksjonsceller.
Det er mye brukt i fremstilling av glass (for eksempel linsene) der utvidelseskoeffisienten reduseres. Det brukes også i keramikkproduksjon. I tillegg har den bruk i fremstilling av emaljer og glasslegeme.
LIF er en drivstoffkomponent for raketter og drivstoff for visse typer reaktorer.
LIF brukes også i lysemitterende dioder eller fotovoltaiske komponenter, for injeksjon av elektroner i indre lag.
Referanser
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- ELLER.S. National Library of Medicine. (2019). Fluorlitium. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov.
- Obryk, f. et al. (2008). Responsen fra forskjellige typer TL-litiumfluoriddetektorer på høye-anergi blandede strålingsfelt. Strålingsmålinger 43 (2008) 1144-1148. Gjenopprettet fra Scientedirect.com.
- Sol, og. et al. (2016). I situal kjemisk syntese av litiumfluor/metall nanokompositt for prelitiering av høy kapasitet av katoder. Nano Letters 2016, 16, 2, 1497-1501. Gjenopprettet fra puber.ACS.org.
- Hennessy, J. og Nikzad, S. (2018). Atomelagsavsetning av litiumfluorid optiske belegg for ultrafiolett. Uorganikk 2018, 6, 46. MDPI kom seg.com.
- « 10 vitenskapelige eksperimenter for fysisk sekundær, kjemi, biologi
- Metylmalonsyrestruktur, egenskaper, syntese, bruk »

