Minimum formel Hvordan fjerne minimumsformelen, eksempler og øvelser
- 3877
- 262
- Prof. Oskar Aas
De Minimum eller empirisk formel Det er et uttrykk for andelen der atomene til de forskjellige elementene som danner en kjemisk forbindelse er til stede. Minimumsformelen er derfor den enkleste representasjonen av en kjemisk forbindelse. Til dette skyldes 'minimum'.
Minimumsformelen uttrykker ikke atomnumrene til de forskjellige elementene som danner en kjemisk forbindelse; men andelen disse atomene kombineres for å generere den kjemiske forbindelsen.
 Denne minimale formelen avslører knapt at forbindelsen har de samme mengdene karbon- og oksygenatomer, og doble hydrogenatomer. Kilde: Gabriel Bolívar.
Denne minimale formelen avslører knapt at forbindelsen har de samme mengdene karbon- og oksygenatomer, og doble hydrogenatomer. Kilde: Gabriel Bolívar. Minimumsformelen kalles også empirisk formel, siden den oppnås fra eksperimentering; det vil si at det er relatert til erfaring. Eksperimentell observasjon tillatt å konkludere med at to hydrogenatomer er kombinert med et hydrogenatom for å danne vann (h2ENTEN).
I mange tilfeller sammenfaller minimumsformelen med den molekylære formelen. I molekylæren vises de reelle antallet av de forskjellige elementene som danner en kjemisk forbindelse; Slik er tilfelle, for eksempel svovelsyre (h2SW4).
Men i andre tilfeller er det ikke tilfeldig av minimumsformelen og molekylformelen; Slik er tilfellet med benzen: minimumsformelen er CH, mens dens molekylære formel er C6H6.
[TOC]
Hvordan få minimumsformelen?
Første skritt
Finn gramene til hvert element som er til stede i forbindelsen. Som vanligvis uttrykt som en prosentandel av massen av forbindelsen, må det gjøres en enkel beregning for transformasjon av massemasseprosentene av elementene.
Andre trinn
Det relative antallet av atomene til de forskjellige elementene som danner den kjemiske forbindelsen oppnås. For å gjøre dette blir massen til hvert element delt, uttrykt i gram, mellom atommassen.
Noen forfattere foretrekker å kalle det relative antallet atomer, for eksempel antall mol atomer i elementene som er en del av den kjemiske forbindelsen.
Kan tjene deg: Butanal: Struktur, egenskaper, bruksområderTredje trinn
Oppnå minimumsandelen, uttrykt i hele tall, av hvert av atomene som er til stede i den kjemiske forbindelsen.
For å finne disse verdiene er de relative tallene til hvert atom som er til stede i forbindelsen mellom den relative numeriske verdien som et atom i den kjemiske forbindelsen er delt.
I tilfelle verdien av minimumsandelen av et atom ikke er et heltall uten desimaler, må alle verdiene på minimumsandelen med et tall multipliseres; På denne måten at det tillater at alle verdiene til minimumsandelen skal være hele tall.
For eksempel, hvis verdien av minimums andelen av et atom i den kjemiske forbindelsen er 2.5, må multipliseres alle Verdiene for minimums andelen av hvert av atomene som er til stede med 2. Dermed vil alle verdiene for minimumsandelen bare være hele tall.
Fjerde trinn
Skriv den minste sammensatte formelen. Verdiene for minimumsandelen for atomene til de forskjellige elementene vil bli plassert som abonnement på de kjemiske symbolene på elementer for å skrive minimumsformelen.
Minimum formeleksempler
Vann og karbondioksid
De fleste kjemiske forbindelser har formler som samtidig er minimums- og molekylære formler. Dermed vannformelen (h2O) er en minimal formel; Men det er også en molekylær formel. Det samme gjelder karbondioksidformelen (CO2).
Grunnleggende og syreoksider
Grunnleggende oksider og syrer er kjemiske forbindelser som har kjemiske formler, med mindre unntatt unntak som både er minimale og molekylære formler. Den samme situasjonen oppstår med hydroksider og syrer, bortsett fra noen karboksylsyrer.
Kan tjene deg: Acetonitril (C2H3N)Eddiksyre
Karboksylsyrer som har et par antall karbonatomer i sammensetningen, er separat, en minimal formel og en molekylær formel. Eddiksyre har for eksempel en molekylær formel (C2H4ENTEN2); Men det presenterer også en minimal formel (Cho2ENTEN).
Butymyre
Også butysyre har en molekylær formel (c4H8ENTEN2) og en minimumsformel (C2H4ENTEN).
Etylenglykol
Andre organiske forbindelser har de to typene kjemiske formler; Slik er tilfellet med etylenglykol, som har en molekylær formel (C2H6ENTEN2) og en minimumsformel (CHO3ENTEN).
Benzen
Benzen, en aromatisk forbindelse, har en molekylær formel (C6H6) og en minimumsformel (CH).
Glukose
Glukose har en molekylær formel (C6H12ENTEN6) og en minimumsformel (CHO2ENTEN).
Løste øvelser
- Oppgave 1
Etylenglykol er en forbindelse som brukes som frostvæske, har en molekylvekt på 62,1 g/mol og en neste masseprosentsammensetning:
C: 38 %,
H: 9,7 %
O: 51,16 %.
Første skritt
Uttrykke masseprosentene av elementene i massene sine i gram. For å gjøre dette blir molekylvekten til etylenglicol tatt som en referanse. Hvis dette er 62,1 gram per mol, består 38% av det samme av karbon. Og så videre med de andre elementene:
Karbonmasse = 62,1 g · (38/100)
= 23,6 g
Hydrogenmasse = 62,1 g · (9,7/100)
= 6.024 g
Oksygenmasse = 62,1 g · (51,16/100)
= 31,77 g
Andre trinn
Beregn det relative nummeret til hvert nåværende atom (NRA) eller antall mol av hvert atom. For å gjøre dette er massen til hvert kjemiske element delt med atommassen.
NRA (c) = 23,6 g / 12 g
= 1,97
Det kan avrundes til 2.
NRA (h) = 6.024 g / 1 g
= 6.024
Det kan avrundes på 6.
NRA (O) = 31,77 g /16 g
= 1.985
Det kan avrundes til 2.
Tredje trinn
Beregn minimums andelen av hele antall elementer i forbindelsen (PMNE). For å gjøre dette er hver av verdiene til de atomiske relative tallene (NRA) delt med den laveste verdien av dette. I dette tilfellet 2.
Det kan tjene deg: propansyrePmne (c) = 2/2
= 1
Pmne (h) = 6/2
= 3
Pmne (o) = 2/2
= 1
Fjerde trinn
Skriv den minimale formelen til etylenglykol:
Ch3ENTEN
Som det kan sees, er verdiene oppnådd i trinn 3 abonnementene på sammensatte elementer.
- Oppgave 2
Eddiksyre har en molekylvekt på 60 g/mol og en følgende masseprosentsammensetning:
C: 40 %
H: 6,67 %
O: 53,33 %
Få minimumsforbindelsesformelen.
Første skritt
Transformer masseprosentene av elementene til massene deres uttrykt i gram:
Karbonmasse = 60 g · (40/100)
= 24 g
Hydrogenmasse = 60 g · (6,67/100)
= 4 g
Oksygenmasse = 60 g · (53,33/100)
= 32 g
Andre trinn
Beregn de relative tallene for atomene (NRA) til forbindelsen. For å gjøre dette er massene av elementene delt mellom atommassene deres:
NRA (c) = 24 g / 12 g
= 2
NRA (h) = 4 g / 1 g
= 4
NRA (O) = 32 g / 16 g
= 2
Tredje trinn
Få minimums andelen hele antall elementer i forbindelsen (PMNE). For å gjøre dette er NRA -verdiene til elementene delt mellom den lavere verdien av NRA som presenterer et element:
Pmne (c) = 2/2
= 1
Pmne (h) = 4/2
= 2
Pmne (o) = 2/2
= 1
Fjerde trinn
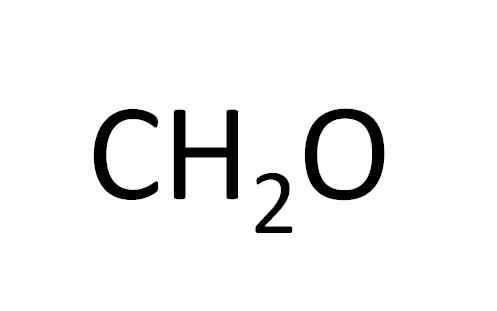
Skriv den minimale formelen til eddiksyre:
Ch2ENTEN
Abonnementene på forbindelsen er verdiene oppnådd fra PMNE.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (27. august 2019). Empirisk formel: Definisjon og eksempel. Gjenopprettet fra: Thoughtco.com
- Wikipedia. (2020). Empirisk formel. Hentet fra: i.Wikipedia.org
- Kjemi librettexts. (3. juli 2019). Empiriske beregningsformler for forbindelser. Gjenopprettet fra: Chem.Librettexts.org
- Nicola McDougal. (2020). Empirisk formel: Definisjon, trinn og eksempel. Studere. Gjenopprettet fra: Studie.com
- « Irreversible reaksjonsegenskaper og eksempler
- Molekylær formel Hvordan få den ut, eksempler og øvelser »

