Fosforhistorie, egenskaper, struktur, innhenting, bruk

- 3214
- 944
- Anders Mathisen
Han kamp Det er et ikke -metallisk element som er representert av det kjemiske symbolet P og har atomnummer 15. Den presenterer tre viktigste allotropiske former: hvit, rød og svart fosfor. Hvit fosfor er fosforescerende, brenner spontant når de blir utsatt for luften og er også svært giftig.
Hvitt fosfor ved 250 ° C av temperatur blir rød fosfor; en polymerform, uoppløselig og som ikke brenner i luften. Ved høye temperaturer og trykk, så vel som i nærvær eller ikke katalysatorer, oppnås svart fosfor, som ligner grafitt og er en god elektrisitetsleder.
 Hvit fosfor lagret i en flaske med vann. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Hvit fosfor lagret i en flaske med vann. Kilde: w. Oelen [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Fosfor ble isolert for første gang av H. Merkevare, i 1669. For å gjøre dette, brukes urin som en kilde til dette elementet. I 1770, w. Scheele oppdaget at han også kunne isolere beinfosfor.
Deretter, på grunn av opprettelsen av den elektriske ovnen av J. Burgess Readman (1800), fosfatbergarter ble den viktigste kilden til fosforproduksjon fra fluoroapatittmalm, til stede i dem.
Fosfor er det tolv rikere elementet i jordskorpen, og representerer 0,1% av det etter vekt. I tillegg er det det sjette elementet i overflod i menneskekroppen; hovedsakelig konsentrert i bein i form av hydroksylapatitt.
Det er derfor et essensielt element for levende vesener, og blir et av de tre viktigste næringsstoffene til planter. Fosfor er en del av den kjemiske strukturen til nukleinsyrer; av energilagringsforbindelser (ATP), koenzymer; og generelt av metabolismeforbindelser.
[TOC]
Historie
- Oppdagelse
I urinen
 Joseph Wright av Derby -maleri der fosforfunnet illustrerer. Kilde: Joseph Wright of Derby [Public Domain]
Joseph Wright av Derby -maleri der fosforfunnet illustrerer. Kilde: Joseph Wright of Derby [Public Domain] Fosfor ble isolert av Henning -merkevaren i 1669, og var det første mennesket som isolerte et element. Brand var en tysk alkymist fra Hamburg og klarte å skaffe en fosforforbindelse fra urin. For å gjøre dette samlet han urinen på 50 bøtter og lot ham dekomponere.
Merket fordampet deretter urinen og fikk en svartaktig rest, som beholdt i flere måneder. Til denne tilsatte sanden og varmet den, klarte å eliminere gasser og oljer. Til slutt fikk han et hvitt fast stoff som lyste i mørket med en grønn farge, som han kalte "kald ild".
Begrepet 'fosfor' kommer tilfeldigvis fra det greske ordet "fosfor" som betyr lysbærer.
Brand publiserte ikke sine eksperimentelle resultater og solgte det til flere alkymister, inkludert: Johann Kraft, Kunckel Lowenstern og Wilhelm Leibniz. Sannsynligvis rapporterte noen av dem arbeidet med merkevare til Academy of Sciences of Paris, og formidler dermed deres undersøkelser.
Imidlertid isolerte merke ikke egentlig fosfor, men ammoniakal natriumfosfat [NH (NH4) Po4]. I 1680 forbedret Robert Boyle merkevarens prosedyre, der han kunne få en alotropisk form for fosfor (P4).
I beinene
Johan Gottlieb Gahn og Carl Wihelm Scheele etablerte i 1769 at en fosforforbindelse, kalsiumfosfat, var i beinene. De ulykke beinene ble utsatt for en fordøyelsesprosess med sterke syrer, for eksempel svovelsyre.
Deretter ble fordøyelsesproduktet oppvarmet i stålbeholdere med kull og kull, og fikk dermed hvit fosfor ved destillasjon i retort. Benene var hovedkilden som oppnådde fosfor til 1840, da de ble erstattet for dette formålet av Guano.
I guano
Guano er en blanding av fugler av fugler og nedbrytningsprodukter av dem. Det ble brukt som en kilde til fosfor og gjødsel på 1800 -tallet.
- Industriell utvikling
Fosfatbergarter ble brukt i 1850 som fosforkilde. Dette, sammen med oppfinnelsen av den elektriske ovnen for å kalsine bergartene av James Burges Readman (1888), laget fosfatiske bergarter til den viktigste råstoffet i fosforproduksjon og gjødsel.
I 1819 ble Cerrillas -fabrikker etablert, og startet den industrielle utviklingen av fosfor.
Fysiske og kjemiske egenskaper
Utseende
Avhengig av den allotropiske formen, kan den være fargeløs, lukket hvit, gul, skarlagen, rød, fiolett eller svart.
Atomvekt
30.973 u
Atomnummer (z)
femten
Smeltepunkt
Hvit fosfor: 44,15 ºC
Rød fosfor: ~ 590 ºC
Kokepunkt
Hvit fosfor: 280,5 ºC
Tetthet (omgivelsestemperatur)
Hvit: 1.823 g/cm3
Rød: 2,2-2,34 g/cm3
Fiolett: 2,36 g/cm3
Svart: 2,69 g/cm3
Fusjonsvarme
Hvit fosfor: 0,66 kJ/mol
Fordampningsvarme
Hvit fosfor: 51,9 kJ/mol
Molar kalorikapasitet
Hvit fosfor: 23.824 J/(mol.K)
Oksidasjonsstater
-3, -2, -1, +1, +2, +3, +4 og +5
Avhengig av elektronegativiteten til elementene som fosfor kan vise oksidasjonstilstanden +3 eller -3. Fosfor, i motsetning til nitrogen, har en tendens til å reagere helst med oksidasjonstilstand +5; Slik er tilfellet med fosforpentoksid (P2ENTEN5 eller s25+ENTEN52+).
Kan tjene deg: løselig materialerElektronegativitet
2,19 på Pauling -skalaen
Ioniseringsenergi
-Først: 1.101 kJ/mol
-For det andre: 2.190,7 kJ/mol
-Tredje: 2.914 kJ/mol
Termisk ledningsevne
Hvit fosfor: 0.236 W/(M · K)
Svart fosfor: 12.1 W/(M · K)
Det viser hvordan svart fosfor driver nesten seks ganger mer varme enn hvit fosfor.
Magnetisk ordre
Hvite, røde, fiolette og svarte kamper er diamagnetiske.
Isotoper
Fosfor har 20 isotoper, og er de viktigste: 31P, den eneste stabile isotopen med en overflod på 100%; 32P, emitter β isotop- og med en halvliv på 14,28 dager; og 33P, en β -emitterisotop- Og med en halvliv på 25,3 dager.
Fosforescens
Hvit fosfor er fosforescerende og avgir et grønt lys i mørket.
Allotropiske endringer
Hvit fosfor er ustabil og endres til temperaturer nær 250 ºC til en polymerform kjent som rød fosfor, som kan variere oransje til lilla oransje. Det er et amorft stoff, men det kan bli krystallinsk; Skinner ikke i mørket eller brenner i luften.
Hvitt fosfor ved høye temperaturer og trykk, eller i nærvær av katalysatorer, transformeres til en annen polymerisk form enn rød fosfor: svart fosfor. Dette er et svart, inert krystallinsk stoff, lik grafitt, og som har muligheten til å utføre strøm.
Løselighet
Hvit fosfor ren er uoppløselig i vann, selv om det kan solubiliseres i karbonsulfid. I mellomtiden er røde og svarte kamper uoppløselige i vannet og er mindre ustabile enn hvitt fosfor.
Reaktivitet
Fosfor brenner spontant i luften for å danne P2ENTEN5, Og dette kan igjen reagere med tre vannmolekyler for å danne ortofosforisk eller fosforsyre (H3Po4).
Ved handling av varmt vann har fosfin (pH (pH3) og fosfor oksacider.
Fosforsyre virker på fosferte bergarter som forårsaker dihydrogen eller superfosfat kalsiumfosfat [CA2Po4)2].
Du kan reagere med halogener for å danne PX -halogenider3, representerer x til f, cl, br eller i; o Haluros med PX -formel5, Å være x, cl eller br.
Fosfor reagerer også med metaller og metalloider for å forårsake fosfider, og svovel for å danne flere sulfider. På den annen side binder det seg til oksygen for å opprinnelige estere. På samme måte er det kombinert med karbon for å danne fosfororganiske forbindelser.
Elektronisk struktur og konfigurasjon
- Lenker og tetrahedral enhet
Fosforatomer har følgende elektroniske konfigurasjon:
[NE] 3S2 3p3
Derfor fem elektroner fra Valencia, for eksempel nitrogen og de andre elementene i gruppe 15. Fordi det er et ikke -metallisk element, må dets atomer danne kovalente bindinger til Octeto de Valencia fullfører. Nitrogen oppnår det når det er etablert som datomiske molekyler n2, Med en trippelkobling, n≡N.
Det samme gjelder fosfor: To av P -atomene er knyttet til en trippelbinding for å danne P -molekylet2, P≡P; Dette er, difosforen Alotrope. Imidlertid har fosfor en større atommasse enn nitrogen, og dets 3p -orbitaler, mer diffuse enn 2p nitrogen, overlapper hverandre med mindre effektivitet; Derfor er P2 Det eksisterer bare i gassformig tilstand.
I stedet, ved romtemperatur, foretrekker atomer P å organisere kovalent på en annen måte: i et tetraedralt molekyl P4:
 P4 molekylære enheter i hvite fosforkrystaller. Kilde: Benjah-BMM27 via Wikipedia.
P4 molekylære enheter i hvite fosforkrystaller. Kilde: Benjah-BMM27 via Wikipedia. Merk at i det overlegne bildet har alle P -atomer tre enkle koblinger i stedet for en trippelkobling. Dermed fosfor i P4 Fullfør Octeto de Valencia. Imidlertid i P4 Det er spenning i P-P-koblingene, siden vinklene deres går til det blotte øye ved å være 109,5 °.
- Alotropes
Hvit fosfor
Det samme bildet av P -enhetene4 Og ustabiliteten forklarer hvorfor hvit fosfor er den mest ustabile alotropiske av dette elementet.
Enhetene s4 De bestilles i verdensrommet for å definere en BCC -krystall (fase α) under normale forhold. Når temperaturen går ned til -77,95 ºC, blir BCC -glasset transformert til en HCP (antagelig), tettere (β -fase). Det vil si P -enhetene4 De bestilles i to alternative lag, A og B, for å etablere en ABAB -sekvens ..
Rød fosfor
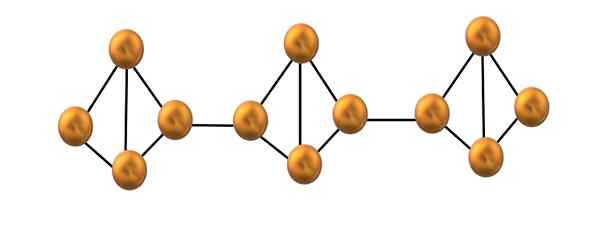 Rød fosforkjedestruktur. Kilde: Gabriel Bolívar.
Rød fosforkjedestruktur. Kilde: Gabriel Bolívar. I det øvre bildet er bare et lite segment av den røde fosforstrukturen vist. Å være de tre enhetene justert "symmetrisk", kan det sies at det er en krystallinsk struktur, som oppnås ved å varme opp denne fosforen over 250 ºC.
Rød fosfor, men mesteparten av tiden består av en solid amorf, så strukturen er rotete. Så de polymere kjedene til P4 De ville ha uten tilsynelatende mønster, en over og andre under det samme flyet vilkårlig.
Merk at dette er den viktigste strukturelle forskjellen mellom hvitt og rødt fosfor: i den første4 De er individuelle, og i de andre formingskjedene. Dette er mulig fordi en av P-P-koblingene er ødelagt inne i tetrahedronen for å kunne koble til nabolandet Tetrahedron. Dermed reduseres den ringformede spenningen og den røde fosforen mer stabilitet.
Kan tjene deg: sink: historie, egenskaper, struktur, risiko, brukNår det er en blanding av begge alotropene, tilbys den i sikte som en gul fosfor; En blanding av tetrahedra og amorfe fosforkjeder. Faktisk hvit fosfor.
Violet eller Hittorf fosfor
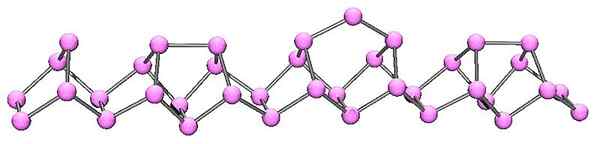 Molekylær struktur av fiolett fosfor. Kilde: Cadmium at English Wikipedia [Public Domain]
Molekylær struktur av fiolett fosfor. Kilde: Cadmium at English Wikipedia [Public Domain] Violet fosfor er den endelige utviklingen av rød fosfor. Som det fremgår av det overlegne bildet, fortsetter det å bestå av en polymerkjede; Men nå er strukturene mer intrikate. Det ser ut til at strukturenheten ikke lenger er P4 men s2, ordnet på en slik måte at de danner uregelmessige femkantede ringer.
Til tross for hvor asymmetrisk strukturen ser ut, klarer disse polymere kjedene å bestille godt nok og med jevne mellomrom slik at fiolett fosfor.
Svart fosfor
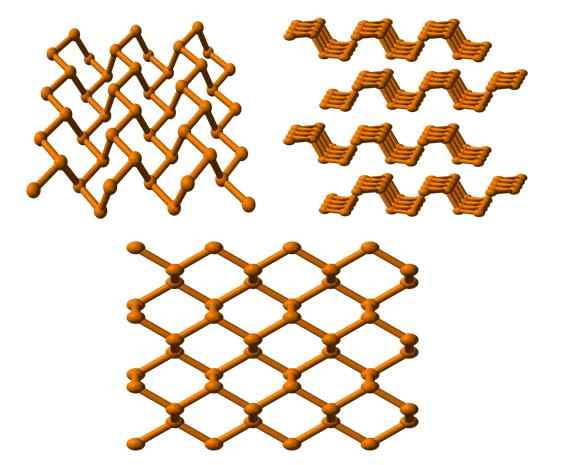 Svart fosforstruktur sett fra flere vinkler. Kilde: Benjah-BMM27 [Public Domain].
Svart fosforstruktur sett fra flere vinkler. Kilde: Benjah-BMM27 [Public Domain]. Og til slutt har vi den mest stabile fosforen Alotrope: den svarte fargen. Forbereder den hvite fosforen under et trykk på 12.000 atm.
I det øvre bildet (nedenfor) kan det sees at strukturen, fra et høyere plan, har en viss likhet med den fra grafitt; Det er et bratt nettverk av sekskantede ringer (selv om de ser firkantet ut).
I øverste venstre hjørne av bildet kan du bedre sette pris på de nykommentarene. Molekylære miljøer av P -atomer er trigonal pyramide. Merk at strukturvisningen sideveis (øverst høyre hjørne) er ordnet i lag som passer på den andre.
Strukturen til den svarte fosforen er ganske symmetrisk og ryddig, noe som stemmer overens med dens evne til å etablere seg som ortorrombiske krystaller. Stabling av polymerlagene forårsaker P -atomer som ikke er tilgjengelige for mange kjemiske reaksjoner; Og det er derfor det er betydelig stabilt og lite reaktivt.
Selv om det ikke er nødvendig å nevne det, er spredningskreftene i London og molmassene til disse fosforfaststoffene de som styrer noen av dens fysiske egenskaper; mens deres strukturer og bindinger P-P definerer de kjemiske egenskapene og andre.
Hvor er det og skaffer seg
Apatita og fosforitt
Det er det tolv elementet i jordskorpen og representerer 0,1% av det etter vekt. Det er omtrent 550 mineraler som inneholder fosfor, og apatita er det viktigste mineralet for å oppnå fosfor.
Apatita er et fosfor- og kalsiummineral som kan inneholde variable mengder fluor, klorid og hydroksyd, hvis formel er som følger: [CA10(Po4)6(F, CL eller OH)2)]. I tillegg til apatitten er det andre fosformineraler av kommersiell betydning; Slik er tilfellet Wavelita og Vivianita.
Fosfat eller fosforittberg er den viktigste fosforkilden. Det er en ikke-retritisk sedimentær bergart som har et 15-20% fosforinnhold. Fosfor er vanligvis til stede som CA10(Po4)6F2 (Fluoroapatita). Det er også til stede som hydroksyapatitt, selv om det i mindre grad.
I tillegg kan fluoroapatitt finnes en del av de stollende og metamorfe bergartene, samt kalkstein og skifer.
Elektrotermisk reduksjon av fluoroapatita
Utvalgte fosfatbergarter overføres til behandlingsanlegget for behandling. Til å begynne med blir de knust for å få steinfragmenter som deretter er malt i kulefabrikker med 70 revolusjoner per minutt.
Deretter blir produktet av sliping av bergfragmentene siktet for å kunne brøk dem. Disse fraksjonene er valgt med et 34% fosforinnhold som fosforpentoksid (P2ENTEN5).
Hvit fosfor (P4) Det oppnås industrielt ved elektrotermisk reduksjon av fluoroapatitt med karbon ved en temperatur på 1.500 ºC i nærvær av silisiumoksyd:
2ca3(Po4)2(S) + 6SIO2(S) + 10 C (S) => P4(g) + casio3(L) + co (g)
P4 I en gassformig tilstand, etter kondensering, blir den samlet og lagret som et hvitt fast stoff nedsenket i vannet for å forhindre reagering med den ytre luften.
Legeringer
Kopp
Fosfordekselet er produsert med forskjellige prosentandeler av kobber og fosfor: Cu 94 % - P 6 %; Cu 92% - P 8%; Cu 85% - P 15%, etc. Legeringen brukes som deoksidant, fuktighetsgivende middel for kobberindustrien og også som en kjerne i aluminiumsindustrien.
Broncine
De er kobber, fosfor og tinnlegeringer som inneholder 0,5 - 11% fosfor og 0,01 - 0,35% tinn. Tinn øker korrosjonsmotstanden, mens fosfor.
Det brukes til utdyping av fjærer, bolter og generelt i artikler som krever tretthet, slitasje og kjemisk korrosjon. Bruken i fartøypropeller anbefales.
Kan tjene deg: kadmium (CD): Historie, egenskaper, struktur, brukNictelladas
Den mest kjente legeringen er nippentjue, Bruk av det fosforerte nikkel i sterke sveiselegeringer, for å forbedre dens motstand mot kjemisk erosjon, oksidasjon og høye temperaturer.
Legeringen brukes i gass- og reaksjonsmotorkomponenter, galvanoplastikk og i produksjonen av sveiseelektroder.
Risiko
Hvit fosfor produserer alvorlig hudforbrenning og er en kraftig gift som kan være dødelig i en dose på 50 mg. Fosfor hemmer celleoksidasjon, og forstyrrer cellulær oksygenbehandling, noe som kan føre til fett degenerasjon og cellens død.
Akutt fosforforgiftning produserer i løpet av de første fire dagene av inntakets magesmerter, ild, pust med lukten av hvitløk, fosforescerende oppkast, svette, muskelkramper og til og med en sjokktilstand.
Deretter er en gulsott, petechiae, blødning, myokardiell påvirkning med arytmier, endring av sentralnervesystemet og døden på den tiende inntaksdagen manifestert.
Den mest åpenbare manifestasjonen av kronisk fosforforgiftning er skade på kjevenes beinstruktur.
En økning i plasmafosforkonsentrasjon (hyperfospathia), presenteres vanligvis hos pasienter med nyresvikt. Dette forårsaker en unormal avsetning av fosfater i mykt vev, noe som kan føre til vaskulær dysfunksjon og hjerte- og karsykdommer.
applikasjoner
Fosfor er et essensielt element for planter og dyr. Det er et av de tre viktigste næringsstoffene til planter, og er nødvendig for deres vekst- og energikrav. I tillegg er det en del av nukleinsyrer, fosfolipider, mellomprodukter av metabolske prosesser, etc.
I virveldyr er fosforen til stede i bein og tenner i form av hydroksylapatitt.
- Elementær fosfor
 En boks med fyrstikker eller "fosfor". Kilde: Pxhere.
En boks med fyrstikker eller "fosfor". Kilde: Pxhere. Med fosfor produseres det en kjemisk emalje som brukes til å belyse merknader plassert på aluminium og dens legeringer; så vel som i kobber og fosforert bronse.
Det brukes også til å lage brennende bomber, granater, røykpumper og sporstoffkuler. Rød fosfor brukes til utdyping av sikkerhetskamper eller kamper.
Hvitt fosfor brukes til utdyping av organofosfat. I tillegg brukes det i produksjonen av fosforsyre.
En stor mengde produsert fosfor er forbrent for produksjon av fosfor -tetraxide (p4ENTEN10), oppnådd som et pulver eller et fast stoff.
- Forbindelser
Fosfin
Det er råstoffet for utdyping av flere fosforforbindelser. Det fungerer som et dopingmiddel for elektroniske komponenter.
Fosforsyre
Det brukes til utdyping av brus på grunn av den karakteristiske smaken som gir dem. Handle på fosfatbergarter for å danne dihydrogen kalsiumfosfat2Po4)2], også kjent som superfosfat, som brukes som gjødsel.
Fosforsyre er et elementbalsam for tannemaljen for å lette vedheftet av materialene i dens restaurering. Den brukes også, blandet med olje, urea, brudd, bitumen og sand, for å danne asfalten; Materiale som brukes i reparasjon av landkommunikasjonskanaler.
Organofosfor
Organofosforforbindelser har mange anvendelser; Slik som: flammehemmere, plantevernmidler, ekstraksjonsmidler, nervehandlingsmidler og vannbehandling.
Dihydrat dihydrat kalsiumfosfat
Det brukes som gjødsel, bakepulver, dyremattilsetningsstoff og i utdyping av tannpastaer.
Fosfor pentoksid
Det brukes i kjemisk analyse som et dehydreringsmiddel og i organisk syntese som kondensatormiddel. Forbindelsen er hovedsakelig tildelt for produksjon av ortofosforsyre.
Natrium tripolyfosfat
Det brukes i vaskemidler og som vannmykner, noe som forbedrer virkningen av vaskemidler og hjelper til med å unngå korrosjon av rørene.
Trisodisk fosfat
Det brukes som et rengjøringsmiddel og vannmykner.
Natriumfosfater
Dibasisk natriumfosfat (Na2Hpo4) og monobasisk natriumfosfat (nah2Po4) er komponentene i et pH -støtdempersystem, som til og med virker i levende vesener; Blant dem mennesker.
Referanser
- Reid Danielle. (2019). Allotropes of Phosphorus: Forms, Uses & Example. Studere. Gjenopprettet fra: Studie.com
- Prof. Robert J. Lancashire. (2014). Foredrag 5c. Struktur av elementene, fortsett P, S og I. Gjenopprettet fra: Chem.Uwimona.Edu.JM
- Byju's. (2019). Fosfor rød. Gjenopprettet fra: Byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang, et al. (2019). Elektroniske strukturelle og optiske egenskaper til flerlags blå fosfor: en første-prinsippstudie. Journal of Nanomaterials, Vol. 2019, artikkel ID 4020762, 8 sider. gjør jeg.org/10.1155/2019/4020762
- Dr. Deig Stewar. (2019). Fosforelementfakta. Chemicool. Gjenopprettet fra: Chemicool.com
- Wikipedia. (2019). Fosfor. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (3. juli 2019). Fosforfakta (atomnummer 15 eller elementsymbol P). Gjenopprettet fra: Thoughtco.com
- Linus Pauling Institute. (2019). Fosfor. Gjenopprettet fra: LPI.Oregonstate.Edu
- Bernardo Fajardo p. & Héctor Lozano V. (s.F.). Nasjonal fosforbergprosessering for superfosfatproduksjon. [PDF]. Gjenopprettet fra: BDigital.en i.Edu.co
- Redaktørene av Enyclopaedia Britannica. (16. november 2018). Fosfor kjemisk element. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Reade International Corp. (2018). Kobberfosfor (kopp) legering. Gjenopprettet fra: Reade.com
- KBM Affilips. (27. desember 2018). Nikkel fosfor (NIP) masterlegering. Azom. Gjenopprettet fra: azom.com
- Lentech b.V. (2019). Periode Tabell: Fosfor. Gjenopprettet fra: Lentech.com
- Abhijit Naik. (21. februar 2018). Fosforbruk. Gjenopprettet fra: Sciencestruck.com
- « Manometrisk trykkforklaring, formler, ligninger, eksempler
- Trincheras kultur opprinnelse, egenskaper, religion, kultur »

