Enheter ionisk kraft, hvordan beregne den, eksempler

- 1938
- 234
- Oliver Christiansen
De ionisk kraft Det er en måte å uttrykke konsentrasjonen av ioner i en løsning på. Dette konseptet ble introdusert i 1922 av Lewis og Randall mens de arbeidet med beskrivelsen av den kjemiske aktivitetskoeffisienten.
Når konsentrasjonen av ionene i en løsning er høy, produseres en elektrostatisk interaksjon mellom de motsatte ionene; Det vil si at kationer og anioner tiltrekkes sterkt, noe som resulterer i effektiv eller reell ionisk konsentrasjon er mindre enn det som er beregnet for en bestemt kjemisk reaksjon.
 Den ioniske kraften av sjøvann er høy, rundt 0.7, på grunn av dens store konsentrasjon av oppløste salter
Den ioniske kraften av sjøvann er høy, rundt 0.7, på grunn av dens store konsentrasjon av oppløste salter Av denne grunn ble begrepet kjemisk aktivitet introdusert som den effektive ioniske konsentrasjonen av en løsning, og den kjemiske aktiviteten var et produkt av molariteten til løsningen ved å koeffisienten for kjemisk aktivitet.
Denne koeffisienten har en verdi nær enheten (1) for utvannede ioniske løsninger og for de så -kallede ideelle løsningene. Dette er løsninger der intermolekylær interaksjon mellom lignende molekyler er lik den som eksisterer mellom forskjellige molekyler.
Opprettelsen av begrepet ionisk kraft bidro til forklaringen av avvik fra ideell atferd, observert i reelle ioniske løsninger.
[TOC]
Ioniske kraftenheter
Den ioniske kraften har som enheter mol/l (molaritet) eller mol/kg vann (moleality). Det siste anbefales i ikke -idealløsninger, som er karakterisert fordi volumene av blandingene deres ikke er totalt tilsetningsstoffer.
Dette betyr for eksempel følgende: Hvis blandet 0.5 liter av en væske A og 0.5 liter av en B -væske, det resulterende volumet av denne blandingen, vil ikke nødvendigvis være lik 1 liter, men kan være annerledes.
Den ioniske kraften er representert med symbolet I.
Kan tjene deg: Butanal: Struktur, egenskaper, bruksområderHvordan beregne ionisk kraft?
For beregning av den ioniske kraften til en løsning, tas konsentrasjonen av alle ionene som er til stede i løsningen, så vel som deres respektive valenser.
Den ioniske kraftverdien oppnås ved å bruke følgende formel:
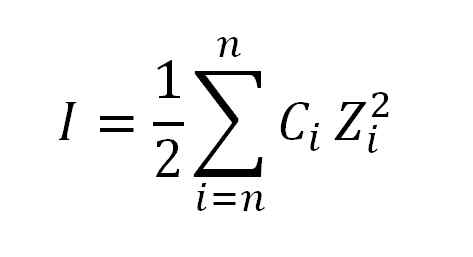 Formel som brukes til å beregne ionisk kraft. Kilde: Gabriel Bolívar.
Formel som brukes til å beregne ionisk kraft. Kilde: Gabriel Bolívar. Hvor jeg, som allerede sagt, er den ioniske kraften; C, tilsvarer den moralske ioniske eller moralske ionekonsentrasjonen; Mens Z representerer deres respektive valens (± 1, ± 2, ± 3, etc.).
Uttrykket som vises i formelen i beregningen av den ioniske kraften (σ) blir lest som sammendrag, det vil si summen av produktet av den molære konsentrasjonen (C) for hvert ion som er til stede i løsningen av dens Valencia (Z) høy kvadrat.
Som det kan sees, har ionens valens den største vekten i verdien av den ioniske kraften til løsningen. For eksempel: Valencia (z) av Ca er +2, så z2 Det er den samme 4. I mellomtiden Valencia (z) av na es +1, og derfor z2 Det er det samme 1.
Dette påpeker at bidraget fra Ion Ca2+ Til verdien av ionisk kraft, til den samme molare ioniske konsentrasjonen, er den fire ganger større enn NA -ionen+.
Viktigheten av ionisk kraft
Den ioniske kraften er et tilstrekkelig mål på den ioniske konsentrasjonen av en løsning og er grunnlaget for å etablere teorien om Debye-Hückel. Denne teorien beskriver den ideelle oppførselen til ioniske løsninger.
Ionisk kraft fungerer som grunnlag for å beregne aktivitetskoeffisienten (γYo), parameter som igjen tillater beregning av den kjemiske aktiviteten til en ionisk forbindelse, og den kjemiske aktiviteten er den effektive og reelle konsentrasjonen av en ionisk forbindelse i løsning.
Kan tjene deg: aluminiumacetat (AL (CH3COO) 3): Struktur, egenskaper, brukVed å øke den ioniske kraften til en løsning, øker interaksjonen mellom ioner. Reduser derfor yYo og den kjemiske aktiviteten til ionene.
En økning i ionisk kraft kan redusere proteinløselighet i et vandig miljø, denne egenskapen brukes til at proteinutfelling er selektivt. Høykraft ionisk kraftsulfatløsninger brukes til nedbør og rensing av plasmaproteiner.
Eksempler på ioniske krefter
Eksempel 1
Beregn den ioniske kraften til en kaliumkloridløsning (KCl) 0.3 m.
KCL dissosierer på følgende måte:
KCl → K+ + Cl-
Vi har to ioner: K -kationen+ (Z =+1) og CL -anionen- (Z = -1). Vi bruker deretter formelen for å beregne den ioniske kraften I:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 11 + 0.3 m · 11]
= 0.3 m
Merk at Valencia -1 av CL- Den ble tatt som 1, dens absolutte verdi, siden ellers ville den ioniske kraften være lik 0.
Eksempel 2
Beregn den ioniske kraften til en kalsiumsulfatoppløsning (tilfelle4) 0.5m
Saken4 Det dissosierer som følger:
Sak4 → Ca2+ + SW42-
Vi har to ioner: CA -kationen2+ (Z =+2) og så anion42- (Z = -2). Vi bruker deretter formelen for å beregne den ioniske kraften I:
I = 1/2 [C · (+2)2 + C · (-2)2]
= 1/2 [0,5 m · 4 +0,5 m · 4]
= 2 m
Eksempel 3
Beregn den ioniske kraften til en støtdemper med de endelige konsentrasjonene av dibasisk natriumfosfat (NA2Hpo4) 0.3 m og monobasisk natriumfosfat (nah2Po4) 0.4 m.
Deretter en2Hpo4 Det dissosierer som følger:
Kan tjene deg: arseninsyre (H3SO4): egenskaper, risikoer og bruksområderNa2Hpo4 → 2. plass+ + Hpo42-
Mens nah2Po4 Det dissosierer etter følgende mønster:
Nah2Po4 → Na+ + H2Po4-
Vi fortsetter som de tidligere øvelsene, denne gangen har HPO -anionene42- (Z = -2) og h2Po4- (Z = -1):
I = 1/2 [C · 2 · (+1)1 + C · (-2)2] +[C · (+1)1 + C · (-1)1]
= 1/2 [0.3 m · 2 · 1 +0.3 m · 4] +[0.4 m · 1 +0.4 m · 1]
= 1/2 [0.6 m +1.2 m] +[0.4 m +0.4 m]
= 1.3 m
Legg merke til at Na -konsentrasjonen+ fra na2Hpo4 Den multipliseres med 2, siden konsentrasjonen er dobbelt. For det andre saltet, nah2Po4, Konsentrasjonen av Na+ Ja, vi multipliserer det med 1, i henhold til støkiometrien i oppløsningsligningen.
Eksempel 4
Beregn den ioniske kraften til en natriumkloridløsning (NaCl) 0.15 m og glukose (C6H12ENTEN6) 0.3 m.
NaCl dissosierer som følger:
NaCl → Na+ + Cl-
Glukose er imidlertid ikke dissosiert på ioner fordi den bare har kovalente typebindinger i sin kjemiske struktur. Derfor er Valencia de la Glucosa (Z) lik null (0). Vi beregner deretter det ioniske kraftproduktet til NaCl:
I = 1/2 [C · (+1)1 + C · (-1)1]
= 1/2 [0.15 m · 1 +0.15 m · 1]
= 0.15 m
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2020). Ionestyrke. Hentet fra: i.Wikipedia.Eller
- Dr. David K. Ryan. (s.F.). Aktivitet og ionisk styrke klasse 4 Ryan. [PDF]. Hentet fra: Faculy.uml.Edu
- University of Michigan. (s.F.). Et mer detaljert blikk på kjemisk balanse. [PDF]. Gjenopprettet fra: Umich.Edu
- Elsevier f.V. (2020). Ionestyrke. Scientedirect. Hentet fra: Scientedirect.com
- C.D. Kennedy. (1990). Ionisk lengde og dinsosiasjon av syrer. [PDF]. Gjenopprettet fra: IUBMB.Online bibliotek.Wiley.com

