GLUT 2 -funksjoner, struktur, funksjoner
- 4768
- 1055
- Prof. Joakim Johansen
GLUT2 Det er en glukosetransportør med lav affinitet som kommer til uttrykk i bukspyttkjertelen, lever-, nyre- og tarmcellemembraner samt astrocytter og tanicitos. I tillegg til å formidle glukosetransport, er den også involvert i transport av fruktose, galaktose og glukosamin; Så mer enn en glukosetransportør er en sekskant transportør.
Det faktum å presentere en lav affinitet for glukose lar deg fungere som et sensorprotein av blodsukkernivå. Delta derfor i forskriftskontrollen av mange fysiologiske hendelser som reagerer på svingninger i blodsukkerkonsentrasjonen.
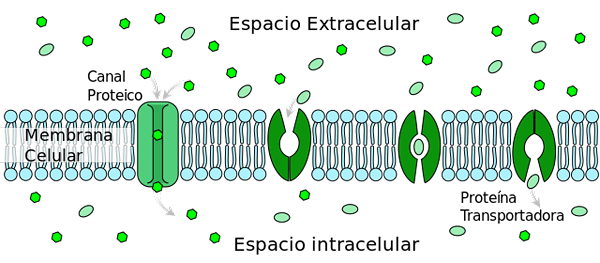
 Den tilrettelagte diffusjonstransporten av glukosetype 2 (GLUT2) endrer konformasjon som mobiliserer glukosebindingsstedet fra yttersiden til den indre membransiden (transportørprotein). Av ladyofhats [offentlig domene] (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons.
Den tilrettelagte diffusjonstransporten av glukosetype 2 (GLUT2) endrer konformasjon som mobiliserer glukosebindingsstedet fra yttersiden til den indre membransiden (transportørprotein). Av ladyofhats [offentlig domene] (https: // creativecommons.Org/lisenser/by-SA/3.0)], fra Wikimedia Commons. Blant de mange prosessene som regulerer er: 1) frigjøring av insulin av bukspyttkjertelen stimulert av høye glukosekonsentrasjoner; 2) Glukagonutskillelse av hepatocytter for glukoseproduksjon i tilfeller av hypoglykemi.
[TOC]
Transport av glukose til celleinteriøret
Omtrent 75% glukose som kommer inn i cellen for å mate de metabolske veiene for energiproduksjon, gjør det gjennom en passiv transportmekanisme forenklet av omfattende membranproteiner kalt transportører.
Denne transportmekanismen er kjent som gitt formidling. Det krever ikke et energibidrag som skal utføres og gis til fordel for en konsentrasjonsgradient. Det vil si fra en høy konsentrasjonssone til en lav konsentrasjon.
Minst 14 isoformer av diffusjonstransperatorer forenklet glukose, inkludert GLUT2, er blitt identifisert til dags dato. Alle av dem som tilhører de viktigste tilretteleggerne superfamily (MSF) og, av enighet, kalt GLUTS (av forkortelsen på engelsk av "Glukosetransportører").
Det kan tjene deg: myitose: faser, egenskaper, funksjoner og organismerDe forskjellige glutene som hittil har blitt karakterisert er kodet av SLC2A -gener og viser markerte forskjeller i aminosyresekvensen, preferansen for underlagene de transporterer og i celle- og vevsfordelingen.
GLUT2 -egenskaper
GLUT2 mobiliserer glukose gjennom en enkelt retning transportmekanisme (uniporta). Denne funksjonen er også utført GLUT1, den mest tallrike glukosetransportøren hos praktisk talt alle pattedyr.
I motsetning til dette har den imidlertid en ekstremt lav affinitet på grunn av glukose, noe som betyr at den bare er i stand til å transportere det når konsentrasjoner av dette sukkeret vanligvis når veldig høye verdier i det ekstracellulære mediet.
Til tross for at den har lav affinitet for glukose, presenterer den høy transportkapasitet, noe som innebærer at den kan transportere store mengder av denne heksosen med høy hastighet. Disse to egenskapene ser ut til å være relatert til rollen som denne transportøren må svare på subtile endringer i glukosekonsentrasjon.
Molekylære karakteriseringsstudier av denne transportøren har vist at dette ikke presenterer en enkelt spesifisitet på grunn av glukose. Tvert imot er det i stand til å formidle den passive transporten av fruktose, galaktose, hånd og glykosamin. Presentere lav affinitet for de tre første og høye affinitetene for glukosamin.
Siden alle disse molekylene er sukker av seks karbonatomer, kan det betraktes som en sekskant transportør i stedet for en glukosetransportør.
GLUT2 -struktur
GLUT2 presenterer en 55% peptidsekvens identisk med den for høye affinitetstransportør for glukosen GLUT1.
Til tross for denne lave prosentandelen av likhet mellom sekvensene til begge transportører, har studier utført med X -Ray Crystallography vist at de har en lignende struktur.
Kan tjene deg: cytoskjelettDenne strukturen tilsvarer den for et multipaso transmembraal protein i α-helix. Det vil si at den krysser membranen flere ganger gjennom transmembransegmenter som har α-helix-konfigurasjon.
Som i alle medlemmer av hovedfasilitatorenes Super Family (MSF), som den tilhører, krysser 12 spiralformede segmenter membranen. Seks av disse omorganiserer romlig for å danne en hydrofil pore som sukker blir mobilisert.
Det skal bemerkes at heksoseforeningsstedet er definert av orienteringen og pseudopsimetri presentert av karboksyl- og aminoterminal aminoendene av proteinet. Begge utsatt for samme side av membranen genererer et hulrom der arrangementet av de seks sukkeratomene er anerkjent tilrettelegging for deres forening.
En endring i transportørens struktur er relatert til mekanismen som brukes av dette for å transportere sukkeret fra den ene siden av membranen. Denne strukturelle deformasjonen gjør det mulig å mobilisere unionsstedet til den cytoplasmatiske siden, der frigjøring av molekylet som er blitt transportert raskt oppstår.
GLUT2 -funksjoner
I tillegg til å formidle glukose, galaktose og glukosamin -kidnapping inne i cellen, har mange fysiologiske funksjoner blitt tilskrevet uttrykket til denne transportøren i forskjellige celletyper.
Mange av disse funksjonene er bestemt ved bruk av genundertrykkelsesteknikker. Det siste består av å forhindre ekspresjon av genet hvis funksjon er ønsket å studere i cellene i et spesifikt vev eller en fullstendig organisme.
I denne forstand har blokaden av GLUT2 -ekspresjon hos mus avslørt at dette proteinet utgjør hovedmidlene for glukosetransport i både nyre- og leverceller. I tillegg til transport av galaktose og fruktose er ikke relatert til generering av glukose fra disse sukkerene via glukoneogenese.
Kan tjene deg: stromatolitterI tillegg er det vist at den utøver en regulatorisk rolle av forskjellige fysiologiske funksjoner, siden dens lave glukoseaffinitet lar den oppdage når konsentrasjonene av dette sukkeret er høye.
GLUT2 -papir i vedlikehold av cellehomeostase
Siden den oppfyller en kritisk funksjon i generering av energi av alle celler, spesielt for nerveceller, må blodkonsentrasjonen opprettholdes nær en verdi av 5mmol/L. Variasjoner i denne konsentrasjonen overvåkes alltid av regulatoriske proteiner gjennom "glukosdeteksjon" -mekanismer.
Disse mekanismene består av molekylære strategier som tillater å svare raskt på plutselige variasjoner i glukosekonsentrasjon. I denne forstand gir GLUT2s uttrykk i cellemembranen hvis funksjoner aktiveres av hyperglykemi en regulatorisk rolle.
Faktisk har det blitt vist at insulinsekresjon av bukspyttkjertelceller utløses av glukosedeteksjon av GLUT2.
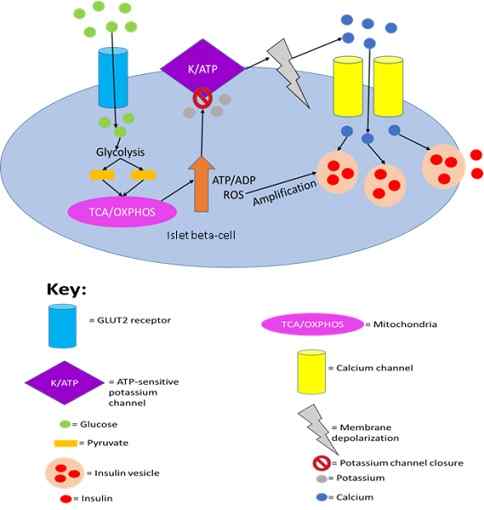
Insulinsekresjon av bukspyttkjertelen blir avfyrt av glukosedeteksjon av GLUT2. Av Joshua J Reed [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons.
I tillegg er gjennomsnittlig den autonome nervøse kontrollen av mat, termoregulering og drift av bukspyttkjertelen stimulert ved glukosedeteksjon.
Når GLUT2 -nivåene avtar i nerveceller, genererer de et positivt signal for å utløse glukagonutskillelse. Husker at glukagon er et hormon som fremmer glukoseproduksjon av leveren fra glykogenreserver.
Referanser
- Burcelin R, Thorens B. Bevis for at ExtrapanCreatic Glut -avhengige glukosesensorer ControlGlcon Secret. Diabetes. 2001; 50 (6): 1282-1289.
- Kellett GL, Brot-Loche E, Mace OJ, Leturque A. Sukkerabsorpsjon i tarmen: GLUT2s rolle. Annu Rev Nutr. 2008; 28: 35-54.
- Lamy CM, Sanno H, Labouèbe G, Picard A, Magnan C, Chatton JY, Thorens B. Hypoglykemi-aktiverte GLUT2-nevroner i Nucleus Tractus Solitaries stimulalerer vagal aktivitet og glukagonhemmelighet. Cellemetab. 2014; 19 (3): 527-538.
- Mueckler M, Thorens B. SLC2 (GLUT) familien av membrantransportører. Mol Aspects Med. 2013; 34 (2-3): 121-38.
- Tarussio D, Metref S, Seyer P, Mounien L, Vallelis D, Magnan C, Foretz M, Thorens B. Nervøs glukosesensing regulerer postnatal ß -celleproliferasjon og glukosehomeostase. J Clin Invest. 2014; 124 (1): 413-424.
- B. GLUT2 i bukspyttkjertelen og ekstra-pancreatic glukuco-deteksjon (gjennomgang). Mol memb biol. 2001; 18 (4): 265-273.
- Thorens B, Mueckler M. Glukosetransportører i det 21. århundre. Am J Physiol Endocrinol Metab. 2010; 298 (2): E141-E145.
- Thorens b. GLUT2, glukosesensing og glukosehomeostase. Diabetologi. 2015; 58 (2): 221-232.
- « Albaricoque -egenskaper, habitat, egenskaper, dyrking
- Coyote -egenskaper, habitat, mat, reproduksjon »

