Glutationegenskaper, struktur, funksjoner, biosyntese
- 1691
- 500
- Prof. Oskar Aas
Han Glutation (Gsh) Det er et lite tripeptidmolekyl (med bare tre ikke -proteinavfall) som deltar i mange biologiske fenomener som enzymatisk mekanikk, makromolekyler biosyntese, mellomliggende metabolisme, oksygen toksisitet, intracellulær transport, etc.
Dette lille peptidet, til stede hos dyr, i planter og i noen bakterier, blir tenkt som en "buffer" Oksid-reduktor, siden det er en av de viktigste forbindelsene med lav molekylvekt som inneholder svovel og mangler toksisitet assosiert med cysteinrester.
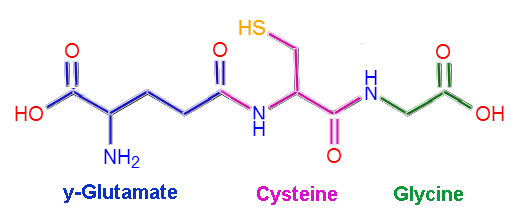
 Molecular Structure of Glutathione (Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Molecular Structure of Glutathione (Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) Noen sykdommer hos mennesker har vært assosiert med mangelen på spesifikke enzymer av glutathione -metabolisme, og dette skyldes deres flere funksjoner i opprettholdelsen av kroppen homeostase.
Underernæring, oksidativt stress og andre patologier som mennesker lider av mennesker kan bevises som en drastisk reduksjon i glutation, så det er noen ganger en god indikator på helsetilstanden til kroppssystemer.
For planter, på samme måte, er glutation.
[TOC]
Kjennetegn
De første studiene som ble utført i forhold til den subcellulære plasseringen av glutathione demonstrerte at den er til stede i mitokondriene. Deretter ble det også observert i regionen som tilsvarer kjernematrisen og i peroksisomer.
For tiden er det kjent at kupeen der konsentrasjonen er rikere er i cytosol, siden det er aktivt produsert og transportert til andre cellekommer som mitokondrier.
I pattedyrceller er glutationkonsentrasjon i området millimoler, mens i blodplasmaet finnes dens reduserte form (GSH) i mikromolare konsentrasjoner.
Denne intracellulære konsentrasjonen ligner konsentrasjonen av glukose, kalium og kolesterol, uunnværlige elementer for cellulær struktur og metabolisme.
Noen organismer har analoge molekyler eller glutation -varianter. Protozoiske parasitter som påvirker pattedyr har en form kjent som "tripanotion", og i noen bakterier erstattes denne forbindelsen av andre sulfuriserte molekyler som tiosulfat og glutamilcystein.
Enkelte arter av planter har, i tillegg til glutation, homologe molekyler som har annet avfall enn glycin i C-terminal enden (homoglutasjon), og som er preget av å presentere funksjoner som ligner på tripépid i spørsmål.
Til tross for eksistensen av andre forbindelser som ligner på glutation i forskjellige organismer, er dette en av "thiolene" som er i større konsentrasjon intracellulært.
Det høye forholdet som normalt eksisterer mellom den reduserte formen (GSH) og den oksiderte formen (GSSG) av glutation, er en annen særegen kjennetegn ved dette molekylet.
Struktur
Gutasjon eller L-German-glutamil-cisteinyl-glycin, som navnet tilsier, er sammensatt av tre aminosyreavfall: L-glutamat, L-cystein og glycin. Cystein- og glycinrester binder seg til hverandre gjennom vanlige peptidkoblinger, det vil si mellom a-karboksylgruppen til den ene aminosyren og a-amino-gruppen til den andre.
Koblingen mellom glutamat og cystein er imidlertid ikke typisk for protein, siden det oppstår mellom y-karboksyldelen av gruppen R av glutamatet og a-amino-gruppen til cystein, så denne lenken er den kalles y lenke.
Dette lille molekylet har en molmasse på litt over 300 g/mol, og tilstedeværelsen av y -koblingen ser ut til å være avgjørende for immuniteten til dette peptidet mot virkningen av mange aminopeptidase -enzymer.
Kan tjene deg: solidaritet mellom arterFunksjoner
Som nevnt er Glutathione et protein som deltar i en rekke cellulære prosesser av dyr, planter og visse prokaryoter. Slik sett kan din generelle deltakelse fremheves i:
-Proteinsyntese og nedbrytningsprosesser
-Dannelsen av ribonukleotidforløpere av DNA
-Regulering av aktiviteten til noen enzymer
-Beskyttelse av celler i nærvær av reaktive oksygenarter (ROS) og andre frie radikaler
-Signaltransduksjon
-Genetisk uttrykk og i
-Programmert celle apoptose eller død
Koenzym
Det har også blitt bestemt at glutation fungerer som koenzym i mange enzymatiske reaksjoner, og at en del av dens betydning er relatert til hva som har kapasitet til å transportere aminosyrer i form av γ-glutamil aminosyrer intracellulært.
Glutationen som kan forlate cellen (som gjør det i sin reduserte form) er i stand til å delta i oksydreduksjonsreaksjoner i nærheten av plasmamembranen og det omkringliggende cellemiljøet, som beskytter skadeceller foran forskjellige typer oksidasjonsmidler.
Cysteinlagring
Denne Tripéptido fungerer også som en cysteinlagringskilde og bidrar til å opprettholde den reduserte tilstanden til proteinsulfhydhylgruppene inne i hemokruppen til hemokruppen til proteinene som inneholder nevnte kofaktor.
Proteinfolding
Når du deltar i proteinfolding, ser det ut til å ha en viktig funksjon som et reduksjonsmiddel for disulfidbroer som er upassende dannet i proteinstrukturer, som vanligvis skyldes eksponering for oksidasjonsmidler som oksygen, hydrogenperoksyd, peroksinitritt og noen superoksider.
Funksjon i erytrocytter
I erytrocytter produsert av enzymreduktase -glutation -peroksidase, som produserer oksidert vann og glutation (GSSG) (GSH) produsert av enzymetreduktasen (GSSG), som produserer oksidert vann og glutation (GSSG), som produserer oksidert vann og glutation (GSSG).
Nedbrytningen av hydrogenperoksyd, og derfor forebygging av dens akkumulering i erytrocytter, forlenger levetiden til disse cellene, siden den unngår den oksidative skaden som kan oppstå i cellemembranen og som kan ende i hemolyse.
Xenobiotisk metabolisme
Glutation er også en viktig hovedperson innen xenobiotisk metabolisme, takket være den S-transferasefulle glutathionenzymvirkningen som genererer glutation-konjugater som deretter kan metaboliseres intracellulært.
Det er lurt.
Oksidativ tilstand av celler
Ettersom glutathione eksisterer i to former, en redusert og en oksidert, bestemmer forholdet mellom begge molekylene redokstilstanden til celler. Hvis GSH/GSSG -forholdet er større enn 100, anses cellene som sunne, men hvis det er nær 1 eller 10, kan det være en indikator på at cellene er i en tilstand av oksidativt stress.
Biosyntese
Tripide-glutathi syntetiseres inne i cellulær, både planter og dyr, ved virkning av to enzymer: (1) den y-glutamilcistine syntetase og (2) syntetasen glutathione (GSH-syntetase), mens dens nedbrytning eller "dekomposisjon" avhenger av handlingen på handlingen), mens den av y-glutamil-transpeptidase-enzymet.
I planteorganismer er hver av enzymene kodet av et enkelt gen og defekter i et av proteinene eller deres kodende gener kan forårsake dødelighet i embryoene.
Kan tjene deg: fylogeniHos mennesket, som hos andre pattedyr, er hovedstedet for syntese og eksport av glutation -spørsmål.
Syntese av novo av glutathione, deres regenerering eller resirkulering, krever at energi fra ATP skal skje.
Redusert glutathione (GSH)
Den reduserte glutationen stammer fra aminosyrene glycin, glutamat og cystein, som allerede nevnt, og syntesen begynner med aktiveringen (ved bruk som det blir angrepet av a-amino-gruppen av cystein.
Denne første kondensasjonsreaksjonen av to aminosyrer blir katalysert av y-glutamilcistein-syntetasen og blir vanligvis påvirket av den intracellulære tilgjengeligheten av aminosyrene glutamat og cystein.
Dipépidet som er dannet blir deretter kondensert med et glycinmolekyl takket være virkningen av syntetasen GSH. Under denne reaksjonen oppstår en ATP-aktivering av a-karboksylgruppen til cystein også for å danne en fosfat-acyl og favoriserer dermed reaksjonen med glycinresten.
Oksidert glutathione (GSSG)
Når den reduserte glutathione deltar i oksydreduksjonsreaksjoner, består den oksiderte formen faktisk av to glutathionmolekyler festet til hverandre gjennom disulfur broer; Det er av denne grunn at den rustne formen er forkortet med forkortelsen "GSSG".
Dannelsen av den oksiderte arten av glutation avhenger av et enzym kjent som men peroksidase eller GSH peroksidase, som er en peroksidase som inneholder en selenocystein (en cysteinrest at i stedet for å ha et svovatom har en av selen) i dets Plasser eiendel.
Interkonversjonen mellom oksiderte og reduserte former blir takket være deltakelse av en GSSG -reduktase eller reduktase -glutation.
Fordelene med inntaket ditt
Glutation kan administreres oral, aktuell, intravenøs, intranasal eller forstøvet for å øke sin systemiske konsentrasjon hos pasienter som lider av oksidativt stress, for eksempel.
Kreft
Undersøkelser utført med hensyn til oral glutation -administrering antyder at inntaket kan redusere risikoen for oral krefttilstand og at administrert sammen med oksidativ kjemoterapeutika, reduserer de negative effektene av terapi hos kreftpasienter.
Hiv
Generelt har pasienter infisert med det ervervede immunsviktvirus (HIV) intracellulære glutation -mangler både i røde blodlegemer og i T -celler og monocytter, noe som betinget deres riktig funksjon.
I en studie utført av Morris og samarbeidspartnere ble det vist at tilførselen av glutation til makrofager fra HIV -positive pasienter i stor grad forbedret funksjonen til disse cellene, spesielt i møte med infeksjoner med opportunistiske patogener som som som som som M. tuberkulose.
Muskelaktivitet
Andre studier har å gjøre med forbedring av kontraktil aktivitet av muskler, antioksidativt forsvar og oksidativ skade forårsaket som respons på iskemi/reperfusjonslesjoner etter GSHs orale administrering under fysisk motstandstrening.
Leverpatologier
Det har på sin side blitt vurdert at dets intravenøse inntak eller administrering har funksjoner i forebygging av fremdriften for noen typer kreft og i reduksjon av celleskader som oppstår som et resultat av visse leverpatologier.
Kan tjene deg: essensielle fettsyrer: funksjoner, betydning, nomenklatur, eksemplerAntioksidant
Selv om ikke alle rapporterte studier er blitt utført hos humane pasienter, men vanligvis er dette tester i dyremodeller (generelt murine), hevder resultatene oppnådd i noen kliniske studier effektiviteten av den eksogene glutathione som antioksidant.
Av denne grunn brukes det til behandling av grå stær og glaukom, som et "anti-aldring" -produkt, for behandling av hepatitt, mange hjertesykdommer, hukommelsestap og for å styrke immunforsvaret, og for rensing etter forgiftning med tungmetaller og medisiner.
"Absorpsjon"
Glutathión administrert eksogent kan ikke komme inn i cellene med mindre den er hydrolysert til deres konstituerende aminosyrer. Derfor er den direkte effekten av administrasjonen (oral eller intravenøs) av denne forbindelsen økningen i GSHs intracellulære konsentrasjon takket være bidraget fra de nødvendige aminosyrene for deres syntese, som effektivt kan transporteres til cytosol.
Bivirkninger
Selv om det anses at glutathioneinntak er "trygt" eller ufarlig, er ikke nok studier på bivirkningene deres blitt utført.
Av de få rapporterte studiene er det imidlertid kjent at det kan ha negative effekter som skyldes interaksjon med andre medisiner, og som kan være helseskadelig i forskjellige fysiologiske sammenhenger.
Hvis det tas på lang sikt, ser det ut til at sinknivået fungerer i overdreven nedgang.
Referanser
- Allen, J., & Bradley, r. (2011). Effekter av oral glutation. Journal of Alternative and Complementary Medicine, 17(9), 827-833.
- Conklin, k. TIL. (2009). Antioksidanter i kostholdet under kreft cellegift: innvirkning på kjemoterapeutisk effektivitet og utvikling av bivirkninger. Ernæring og kreft, 37(1), 1-18.
- Meister, a. (1988). Glutathione -metabolisme og dens selektive modifisering. Journal of Biological Chemistry, 263(33), 17205-17208.
- Meister, a., & Anderson, M. OG. (1983). Glutathione. Ann. Rev Biochem., 52, 711-760.
- Morris, d., Krig, c., Khurasany, m., Guilford, f., & SAVIOLA, B. (2013). Glutathiona Tilleggsforbedring Makrofagfunksjoner i HIV. Journal of Interferon & Cytokine Research, elleve.
- Murray, r., Bender, d., Botham, k., Kennelly, p., Rodwell, v., & Weil, P. (2009). Harpers illustrerte biokjemi (28. utg.). McGraw-Hill Medical.
- Nelson, d. L., & Cox, m. M. (2009). Lehninger prinsipper for biokjemi. Omega -utgaver (5. utg.). https: // doi.org/10.1007/S13398-014-0173-7.2
- Noctor, g., Mhamdi, a., Chaouch, s., Han, og. Yo., Neukermans, J., Marquez-Garcia, f.,... foajé, c. H. (2012). Glutathione i planter: En integrert oversikt. Plante, celle og miljø, 35, 454-484.
- Pizzorno, J. (2014). Glutathione! Undersøkelsesmedisin, 1. 3(1), 8-12.
- Qanungo, s., Starke, d. W., Pai, h. V, Myyal, J. J., & Nieminen, til. (2007). Glutation. Journal of Biological Chemistry, 282(25), 18427-18436.
- Ramires, p. R., & Ji, l. L. (2001). Glutathiona-tilskudd og trening øker myokardisk motstand mot iskemi-reperfusjon in vivo. Ann. J. Fysiol. Hjertet sirk. Fysiol., 281, 679-688.
- Sies, h. (2000). Glutathione og dens rolle i cellulære funksjoner. Free Radical Biology & Medicine R, 27(99), 916-921.
- Wu, g., Fang, og., Yang, s., Lupton, J. R., & Turner, n. D. (2004). Glutathione -metabolisme og dens implikasjoner for helse. American Society for Nutritional Sciences, 489-492.

