Nitgallsyre (HNO2) struktur, egenskaper, syntese

- 1699
- 185
- Theodor Anders Hopland
Han lystaltsyre Det er en svak, uorganisk syre, hvis kjemiske formel er HNO2. Det er grunnleggende i vandig løsning med en blekblå farge. Det er veldig ustabilt, og den blir raskt brutt inn i nitrogenoksid, nei og i salpetersyre, Ino3.
Det er vanligvis i vandig løsning i form av nitritter. Det kommer også naturlig fra atmosfæren som et resultat av reaksjonen av nitrogenoksid med vann. Der, spesielt i troposfæren, griper det nitersyre i reguleringen av ozonkonsentrasjon.
 Lystgalløsning i et begerglass. Kilde: Ingen maskinlesbar forfatter gitt. The Mad Scientist ~ Commonswiki antok (basert på krav om opphavsrett)). [Offentlig domene]
Lystgalløsning i et begerglass. Kilde: Ingen maskinlesbar forfatter gitt. The Mad Scientist ~ Commonswiki antok (basert på krav om opphavsrett)). [Offentlig domene] I det øvre bildet vises en HNO -løsning2 der den karakteristiske blekblå fargen på denne syren kan sees. Det syntetiseres ved oppløsningen av nitrogentrioksid, n2ENTEN3, I vann. På samme måte er det produktet av forsuring av natriumnitrittløsninger ved lave temperaturer.
HNO2 Den har lite kommersiell bruk, ved å bruke i form av nitritt i bevaring av kjøtt. På den annen side brukes det i utdyping av azoiske fargestoffer.
Det brukes sammen med natriumtiosulfat i behandlingen av pasienter med natriumcyanidforgiftning. Men det er et mutagent middel, og det antas at det kan forårsake substitusjoner i basene til DNA -kjedene, gjennom en oksidativ deaminering av cytosin og adenin.
Nitgallsyre har en dobbel oppførsel, siden den kan oppføre seg som et oksidativt middel eller som et reduserende middel; det vil si at det kan reduseres til ingen eller n2, oksiderer3.
[TOC]
Nitgolesyrestruktur
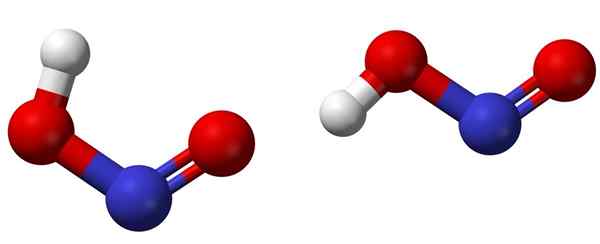 Cis (venstre) og trans (høyre) isomerer med de respektive molekylære strukturer av HNO2. Kilde: Ben Mills [Public Domain].
Cis (venstre) og trans (høyre) isomerer med de respektive molekylære strukturer av HNO2. Kilde: Ben Mills [Public Domain]. Det øvre bildet viser molekylstrukturen til nitersyre ved hjelp av en kuler og bars -modell. Nitrogenatom (blå sfære) er lokalisert i midten av strukturen, og danner en dobbeltbinding (n = O) og en enkel (n-o) med oksygenatomer (røde kuler).
Merk at hydrogenatom (hvit sfære) er knyttet til en av oksygenet og ikke direkte til nitrogen. Så å vite dette, den strukturelle formelen til HNO2 Det er [ho-n = o] eller [nei (OH)], og det er ingen slik H-N-kobling (som den kjemiske formelen kan tenke).
Bildemolekylene tilsvarer de i en gassfase; I vannet er de omgitt av vannmolekyler, som kan akseptere hydrogenionet (svakt) for å danne ionene ikke2- og h3ENTEN+.
Kan tjene deg: BeakerStrukturen kan ta i bruk to former: cis eller trans, kalt geometriske isomerer. I cis -isomeren blir H -atomet formørket med det nærliggende oksygenatom; Mens du er i trans -isomeren, finnes begge deler i anti -synkosisjonsposisjoner.
I cis-isomeren er dannelsen av et intramolekylært hydrogen (OH-NO) sannsynligvis, noe som kan importere intermolekylær (OnOH-Onoh).
Egenskaper
Kjemiske navn
-Lystaltsyre
-Diokonitrissyre (III)
-Nitrosile hydroksyd
-Hydroxideoxidonitrogen (iupac systematisk navn)
Fysisk beskrivelse
Blekblå væske, tilsvarende nitrittløsningen.
Molekylær vekt
47,013 g/mol.
Dissosiasjonskonstant
Det er en svak syre. PKA er 3,35 til 25 ºC.
Smeltepunkt
Er bare kjent i løsning. Derfor kan ikke smeltepunktet ditt beregnes, og krystallene dine kan heller ikke isoleres.
Kokepunkt
Ved ikke å være ren, men i vann, er målingene av denne egenskapen ikke presise. På den ene siden avhenger det av konsentrasjonen av HNO2, Og på den andre produserer oppvarmingen sin nedbrytning. Det er grunnen til at et eksakt kokepunkt ikke rapporteres.
Salgsdannelse
Oppløselig vann -oppløselige nitritter med Li+, Na+, K+, Ac2+, MR2+, Ba2+. Men ikke danner salter med allsidige kationer, for eksempel: til3+ og/eller være2+ (På grunn av den høye belastningstettheten). Den er i stand til å danne stabile estere med alkoholer.
Brannpotensial
Det er brannfarlig for kjemiske reaksjoner. Kan eksplodere ved kontakt med fosfor -triklorid.
Nedbrytning
Det er en veldig ustabil forbindelse, og i vandig løsning dekomponerer den i nitrogenoksid og salpetersyre:
2 hno2 => Nei2 + NO +H2ENTEN
4 hno2 => 2 HNO3 + N2Eller +h2ENTEN
Reduksjonsmiddel
Nitgallsyre i vandig oppløsning presenteres i form av nitrittioner, nei2-, som opplever flere reduksjonsreaksjoner.
Reagerer med ioner i- og tro2+, I form av kaliumnitritt, for å danne nitrogenoksid:
2 Kno2 + Ki +h2SW4 => I2 + 2 Nei +2 H2Eller +k2SW2
Kaliumnitritt i nærvær av tinnioner reduseres til å danne lystgass:
Kno2 + 6 HCl +2 SNCL2 => 2 SNCL4 + N2O +3 H2O +2 KCl
Kan tjene deg: Berylhydroksid (BE (OH) 2)Kaliumnitritt reduseres med Zn i et alkalisk miljø, og danner ammoniakk:
5 H2O +KNO2 + 3 Zn => NH3 + KOH +3 Zn (OH)2
Oksidasjonsmiddel
I tillegg til å være et reduserende middel, kan lystaltesyre gripe inn i oksidasjonsprosesser. For eksempel: oksiderer for å hydrogensulfid, bli salpetrogen eller ammoniakkoksid, avhengig av surheten til mediet som reaksjonen oppstår.
2 hno2 + H2S => S +2 NO +2 H2ENTEN
Hno2 + 3 H2S => S +NH3 + 2 h2ENTEN
Nitallsyre, i et surt pH -medium, kan oksidere jodidion til jod.
Hno2 + Yo- + 6 timer+ => 3 i2 + NH3 + 2 h2ENTEN
Du kan også fungere som et reduserende middel som handler på CU2+, forårsaker salpetersyre.
Nomenklatur
Til HNO2 Du kan oppgi andre navn, som er avhengig av typen nomenklatur. Nitgallsyre tilsvarer den tradisjonelle nomenklaturen; Diokonitrissyre (III), til bestandsnomenklaturen; og dioxonitrat (iii) av hydrogen, til systematisk.
Syntese
Nitgallsyre kan syntetiseres ved å oppløse nitrogentrioksid i vann:
N2ENTEN3 + H2O => 2 hno2
En annen metode for forberedelse er reaksjonen fra natriumnitritt, nano3, med mineralsyrer; for eksempel saltsyre og bromtersyre. Reaksjonen blir gjort ved lav temperatur og lystaltesyre konsumeres in situ.
Eldre bror3 + H+ => Hno2 + Na+
H+ Det kommer enten fra HCL eller HBR.
Risiko
Gitt dens kjemiske egenskaper og egenskaper, er det lite informasjon om de direkte giftige effektene av HNO2. Kanskje er noen skadelige effekter som antas er produsert av denne forbindelsen, faktisk forårsaket av salpetersyre, som kan oppstå ved nedbrytende nitgallsyre.
Det påpekes at HNO2 Det kan ha skadelige effekter på luftveiene og kunne gi symptomer på irritasjon hos astmatiske pasienter.
I form av natriumnitritt reduseres det med deoksyhemoglobin, og produserer nitrogenoksid. Dette er en kraftig vasodilator som produserer avslapning av de vaskulære glatte musklene, og estimerer hos mennesker en LD50 -dose på 35 mg/kg for oralt forbruk.
Nitritt -toksisitet natrium nitritt manifesteres med en kardiovaskulær kollaps, etterfulgt av alvorlig hypotensjon, på grunn av vasodilatorvirkning av nitrogenoksid, produsert fra nitritt.
Nitrogendioksid, nei2, Til stede i forurenset luft (SMOG), under visse forhold, kan det forårsake lystgass; som igjen kan reagere med aminer for å danne nitrosamin, en gamma av kreftfremkallende forbindelser.
Det kan tjene deg: sølvoksid (Ag2o)En lignende reaksjon oppstår med røyk av sigaretter. Nitrosaminrester som fulgte interiørfôret av røykekjøretøyer er funnet.
applikasjoner
Diazoniumsalgsproduksjon
Nitgallyr brukes i bransjen i produksjon av diazoniumsalter, gjennom dens reaksjon med aromatiske aminer og fenoler.
Hno2 + Rnah2 + H+ => RNA = NAR +H2ENTEN
Diazoniumsalter brukes i organiske synteseaksjoner; For eksempel i Sandmeyers reaksjon. I denne reaksjonen forekommer erstatningen av en aminogruppe (h2N-), i en primær aromatisk amin, av CL-gruppene-, Br- og CN-. For å få disse aromatiske produktene, kreves couPro -salter.
Diazoniumsalter kan danne strålende takforbindelser som brukes som fargestoffer og også tjene som en kvalitativ test for å oppdage tilstedeværelsen av aromatiske aminer.
Natrium azida eliminering
Nitgallsyre brukes til å eliminere natriumazid3), noe som potensielt er farlig for sin tendens til å utnytte.
2 Nan3 + 2 hno2 => 3 n2 + 2 NO +2 NaOH
Syntese av oksimas
Nitgallsyre kan reagere med ketongrupper for å danne oksimas. Disse kan oksideres for å danne karboksiler eller redusert syre for å forårsake amin.
Denne prosessen brukes i kommersiell fremstilling av adipinsyre, en monomer som brukes i nylonproduksjon. Det griper også inn i produksjonen av polyuretan og dets estere er myknere, hovedsakelig i PVC.
Under saltformen
Nitgallsyre, i form av natriumnitritt, brukes i behandling og bevaring av kjøtt; Siden forhindrer det bakterievekst og er i stand til å reagere med myoglobin, og produserer en mørkerød farge som gjør kjøtt mer attraktivt for forbruket.
Det samme saltet brukes sammen med natriumtiosulfat, i den intravenøse behandlingen av natriumcyanidforgiftning.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10th Utgave.). Wiley Plus.
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Pubchem. (2019). Lystaltsyre. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Softschools. (2019). Lystaltsyre. Gjenopprettet fra: softschools.com
- Wikipedia. (2019). Lystaltsyre. Hentet fra: i.Wikipedia.org
- Royal Society of Chemistry. (2015). Lystaltsyre. Gjenopprettet fra: Chemspider.com
- New World Encyclopedia. (2015). Lystaltsyre. Gjenopprettet fra: Newworldyclopedia.org
- DrugBank. (2019). Lystaltsyre. Gjenopprettet fra: DrugBank.Ac
- Kjemisk formulering. (2018). Hno2. Gjenopprettet fra: Quimica -formulering.com
- « Tall eller indikatorer som snakker om utdanningsutvikling i et land
- Alkyl Halogenuros egenskaper, innhenting, eksempler »

