Heksokinasestrukturer, funksjoner, skjemaer
- 3071
- 573
- Marius Aasen
De Hexoquinase (HK) er enzymet som katalyserer den første reaksjonen av den glykolytiske ruten praktisk talt i alle levende organismer, både i prokaryoter og i eukaryoter. Det er ansvarlig for overføring av en fosforylgruppe mot glukose, og produserer glukose-6p, selv om den også kan fosforylere andre sekskant sukker (av 6 karbonatomer).
Dette enzymet er klassifisert i en av de to familiene til glukose -kinase -enzymer (enzymer som overfører fosforylgrupper til underlag som glukose): Hexoquinase -familien (HK), hvis medlemmer er delt inn i tre forskjellige grupper kjent som HK -gruppen, den Gruppe A og gruppe B.
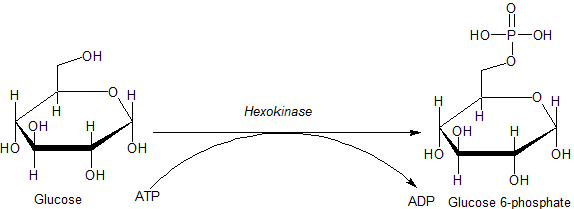
 Reaksjon katalysert av heksoquinase -enzymet (kilde: JMUN7616 [Public Domain] via Wikimedia Commons)
Reaksjon katalysert av heksoquinase -enzymet (kilde: JMUN7616 [Public Domain] via Wikimedia Commons) Enzymene som tilhører HK -familien er preget av glukosefosforylering på bekostning av ATP som en fosforylgruppedonatormolekyl, og medlemmene av det er forskjellige fra hverandre hovedsakelig med hensyn til deres molekylvekt og underlagsspesifisitet.
HK-gruppen tilhører enzymene til eukaryote organismer (ATP: D-heksose 6-fosfotransferaser), i mellomtiden er gruppe A representert av enzymene til de gramnegative bakteriene, cyanobakterier, amithokondrierte og tripanosomatidale protister, og gruppe B-inneholder enzzen av Gramanosomatid-protister, og gruppe B-inneholder enzzen av gramanosomatidalprotister, og gruppe B-inneholder enzen med gramanosomatidal protister, og gruppe B-inneholder enzen av gramosomanatidale protister, cyanobakterier, amithokondriert og tripanosomatal protister, cyanobakterier, amithokondriat og tripanosomatal protister, cyanobakterien, amithokondriert og tripanosomatale protister, cyanobakterien, amitho. -positive bakterier og creanarqueotas organismer.
Enzymer av gruppe A og B er også kjent som glycoquinases (GLCKs), da de utelukkende er i stand til å utelukkende glukosefosforylering, og det er grunnen til.
Ettersom glykolytisk enzym har heksokinase stor metabolsk betydning, fordi uten den ville denne viktige ruten ikke være mulig, og cellene som er veldig avhengig av karbohydratforbruk som for eksempel hjerne- og muskelceller til mange pattedyr, ville ha alvorlige funksjonelle og fysiologiske hindringer Generelt.
[TOC]
Struktur
Som det fremgår senere, hos pattedyr og andre virveldyr (så vel som i encellede organismer som gjær) er det forskjellige typer heksoquinase -enzymer. Hos pattedyr er fire beskrevet: Isoforms I, II, III og IV.
Kan tjene deg: jernholdig legeringer: egenskaper, typer, eksemplerDe tre første isoenzymene har 100 kDa molekylvekt, men isoenzymet IV har 50 kDa. Disse isoenzymene (spesielt I-III) viser høy likhet med sekvensen mellom dem med hensyn til deres C- og N-terminale ender, så vel som andre medlemmer av hexoquinase-familien.
Det N-terminale domenet til disse enzymene regnes som "regulator" -domenet, mens katalytisk aktivitet utføres av det C-terminale domenet (HK II av pattedyr har aktive steder i begge domenene).
Det N-terminale domenet er koblet til det C-terminale domenet gjennom en alfa-propell, hver og en har omtrent 50 kDa molekylvekt og har et veikryss for glukose.
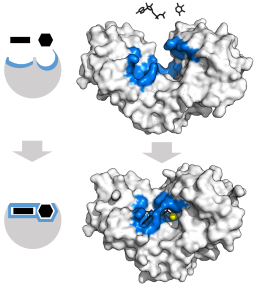 Indusert justeringsmodell for heksokinaseenzymet (med hensyn til dens to underlag: ATP og glukosen) (Kilde: Thomas Shafee [CC med 4.0 (https: // creativecommons.Org/lisenser/av/4.0)] via Wikimedia Commons)
Indusert justeringsmodell for heksokinaseenzymet (med hensyn til dens to underlag: ATP og glukosen) (Kilde: Thomas Shafee [CC med 4.0 (https: // creativecommons.Org/lisenser/av/4.0)] via Wikimedia Commons) Den tertiære strukturen til disse enzymene er i hovedsak sammensatt av ß-plasserte ark blandet med alfa-propeller, hvis andel varierer med hensyn til enzymet og arten det gjelder; Unionsstedet for ATP, det andre heksokinasesubstratet, er vanligvis sammensatt av fem β -ark og to alfa -propeller.
Funksjoner
Heksokinase har en transcendental funksjon i karbohydratmetabolisme hos de fleste levende vesener, siden katalyserer det første trinnet i den glykolytiske ruten, medierer fosforylering av glukose inni.
Dette første trinnet med glykolyse, som består av overføringen av en fosforylgruppe fra ATP (giver) til glukose, og gir 6-fosfat og ADP glukose, er den første av de to energiinvesteringstrinnene i form av ATP.
I tillegg er reaksjonen katalysert av heksokinase passering av "aktivering" av glukose for påfølgende prosessering og representerer et trinn av "engasjement", siden glukose således fosforylerte ikke kan forlate cellen gjennom sine konvensjonelle transportører i membranplasmaet.
Kan tjene deg: heterogene blandingerProduktet av reaksjonen katalysert av heksokinase, det vil si 6-fosfatglukosen, er et poeng av gren, siden det er det første underlaget som brukes på ruten til pentosefosfat og i syntesen av glykogen i mange dyr (og av stivelsen på planter).
I planter
Funksjonen til heksokinase i planter er ikke veldig forskjellig fra dyr eller mikroorganismer, men i de øvre plantene fungerer dette enzymet også som en "sensor" av sukkerkonsentrasjon.
Betydningen av denne funksjonen i disse organismer har å gjøre med deltakelse av sukker som reguleringsfaktorer i uttrykket av gener som er involvert i forskjellige metabolske prosesser som:
- Fotosyntese
- Glioxylatsyklusen
- Pusten
- Forringelse eller syntese av stivelse og sukrose
- Nitrogenmetabolisme
- Forsvaret mot patogener
- Cellesyklusregulering
- Helbredende respons
- Pymentering
- Senescence, blant andre.
Denne funksjonen av heksokinase som en "sensor" av mengden intracellulær glukose er også blitt beskrevet for gjær og pattedyr.
Former
I naturen er det forskjellige former for heksokinaser, og dette avhenger grunnleggende av arten som blir vurdert.
Hos mennesker og andre virveldyr, for eksempel, er eksistensen av 4 forskjellige isoformer av heksokinase -enzymet i det cytosoliske rommet påvist, som det er betegnet med de romertiske tallene I, II, III og IV.
Isoenzymer, II og III er 100 kDa molekylvekt, blir hemmet av deres reaksjonsprodukt (6-fosfat glukose) og er veldig relatert til glukose, det vil si at de har en veldig lav km konstant. Imidlertid har disse enzymene liten spesifisitet av underlag, og kan fosforylere andre heksoser som fruktose og hånd.
Kan tjene deg: syrer: egenskaper og eksemplerIsoenzymet IV, også kjent som glycoquinase (GLCK), har bare 50 kDa molekylvekt og til tross for at de er lite relatert (høye km -verdier), har en høy spesifisitet med glukose som et underlag og ikke er underlagt dem reguleringsmekanismer som den andre Tre isoenzymer.
Glucoquinase (isoenzym IV av heksokinasen til mange pattedyr) finnes hovedsakelig i leveren og hjelper dette organet i "justeringen" av glukoseforbrukshastigheten som respons på variasjonene i dette underlaget i det sirkulerende blodet.
De tre genene som koder for heksoquinaser I, II og III hos dyr, virker bare III bosatt i den C-terminale enden.
Referanser
- Aronoff, s. L., Berkowitz, k., Shreiner, f., & Ønsker, l. (2004). Glukosemetabolisme og regulering: utover insulin og glukagon. Spectrum Diabetes, 17(3), 183-190.
- Harrington, g. N., & Bush, D. R. (2003). Den bifuncionale rollen til heksokinase i metabolisme og glukosesignalering. Plantecellen, femten(11), 2493-2496.
- Jang, J. C., León, p., Zhou, l., & Sheen, J. (1997). Heksokinase med hensyn til sukkersensor i høyere planter. Plantecellen, 9(1), 5-19.
- Kawai, s., Mukai, t., Mori, s., Mikami, f., & Murata, K. (2005). Hypotese: strukturer, evolusjon og stamfar til glukosekinaser i heksokinase -familien. Journal of Bioscience and BioEngineering, 99(4), 320-330.
- Mathews, k. OG. (1998). Van Holde. Biokjemi.
- Wilson, J. OG. (2003). Isozymer av pattedyrheksokinase: struktur, subcellulær lokalisering og metabolsk funksjon. Journal of Experimental Biology, 206(12), 2049-2057.
- « 13 juice for å kurere gastritt (naturlig og effektiv)
- Divergerende evolusjonsårsaker og eksempler »

