Hydrolyse hva som består og eksempler på reaksjoner
- 1586
- 485
- Jonathan Moe
De hydrolyse Det er en kjemisk reaksjon som kan oppstå i både uorganiske og organiske molekyler eller ioner, og som innebærer deltakelse av vann for nedbrytning av bindinger. Navnet hans stammer fra det greske, 'vannet' og 'lyser' av brudd.
Vannmolekylet, h2Eller det etablerer en balanse med ionene av syresalter og svake baser, og vises for første gang dette konseptet i generelle studier av kjemi og i analytisk kjemi. Det er derfor en av de enkleste kjemiske reaksjonene.
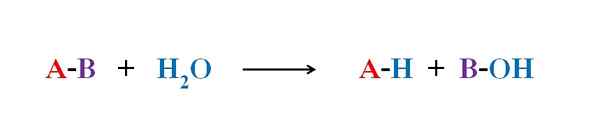 Generell ligning for en hydrolysereaksjon. Kilde: Gabriel Bolívar.
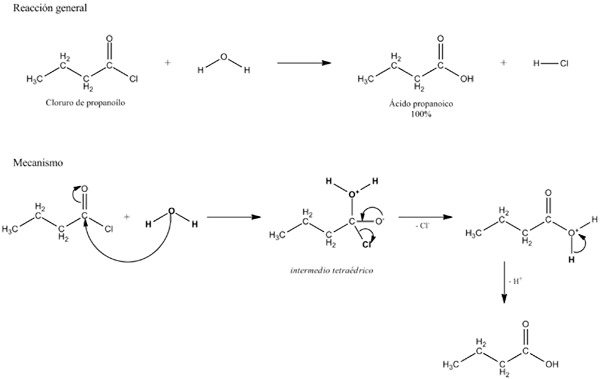
Generell ligning for en hydrolysereaksjon. Kilde: Gabriel Bolívar. I flere eksempler på hydrolyse er vann alene ikke i stand til å bryte en viss kovalent binding. Når dette skjer, akselererer prosessen eller katalyserer ved forsur eller alkalisering av mediet; det vil si i nærvær av H -ioner3ENTEN+ eller åh-, henholdsvis. Det er også enzymer som katalyserer hydrolyse.
Hydrolyse inntar en spesiell plass når det. For eksempel hydrolyseres sukker for å dekomponere polysakkarider i sine konstituerende monosakkarider takket være virkningen av glukosidase -enzymer.
[TOC]
Hva er hydrolyse?
Det øvre bildet forklarer hva hydrolyse består av. Merk at ikke bare molekylet eller underlaget (hvis de formidler enzymer) bryter koblingen, men også selve vannet, som er "brudd" i H+ Og åh-, Hvor h+ ender med en, og oh- med b. A-B reagerer med et vannmolekyl med opprinnelse av to produkter, A-H og B-OH.
Hydrolyse er derfor reaksjonen i strid med kondensasjon. I kondensasjonen er to produkter, for å si A-H og B-OH, binder ved frigjøring av et lite molekyl: vann. I hydrolyse forbrukes et molekyl, mens det i kondens frigjøres eller produseres.
Det kan tjene deg: karbonylgruppe: egenskaper, egenskaper, nomenklatur, reaktivitetGå tilbake til eksemplet med sukker, antar at A-B tilsvarer en sukrose-dimer, der han representerer glukose, og B fruktose. A-B, glukosidisk kobling kan hydrolysarisere for å opprinnelig de to monosakkaridene hver for seg og i løsning, og det samme skjer med oligo og polysakkarider hvis de formidler enzymer i slike reaksjoner.
Legg merke til at i denne reaksjonen, den fra A-B, har pilen bare en adresse; det vil si at det er en irreversibel hydrolyse. Imidlertid er mange hydrolyse faktisk reversible reaksjoner som når en balanse.
Eksempler på hydrolysereaksjoner
- ATP
ATP er stabil mellom pH -verdier på 6,8 og 7,4. Imidlertid, ved ekstreme pH -verdier, hydrolyseres det spontant. I levende vesener katalyseres hydrolyse av enzymer kjent som atasas:
ATP +H2O => adp +pi
Denne reaksjonen er sterkt eksergonisk, siden entropien til ADP er større enn for ATP. Gibbs fri energivariasjon (Δgº) er - 30,5 kJ/mol. Energien produsert av ATP -hydrolyse brukes i en rekke Endergon -reaksjoner.
Koblede reaksjoner
I noen tilfeller brukes ATP -hydrolyse for konvertering av en forbindelse i en forbindelse (B).
A +ATP +H2Eller b +adp +pi +h+
- Vann
To vannmolekyler kan reagere på hverandre i en tilsynelatende hydrolyse:
H2Eller + h2Eller h3ENTEN+ + Åh-
Det er som om en av disse vannmolekylene har blitt strukket i H+ Og åh-, kommer til å koble h+ Til oksygenatomet i det andre vannmolekylet, som forårsaker hydriumion, h3ENTEN+. Denne reaksjonen, mer enn hydrolyse, handler om selvpropotolyse av vann.
Kan tjene deg: aktiveringsenergi- Proteiner
Proteiner er stabile makromolekyler og for å oppnå deres komplette hydrolyse, i aminosyrene som utgjør dem, er det nødvendig med ekstreme forhold; for eksempel en konsentrasjon av saltsyre (6 m) og høye temperaturer.
Imidlertid er levende vesener utstyrt med et enzymatisk arsenal som tillater hydrolyse av proteiner i aminosyrer i tolvfingertarmen. Enzymene som er involvert i fordøyelse av proteiner blir nesten utskilt av bukspyttkjertelen.
Det er eksopeptidase -enzymer som nedbryter proteiner, og starter i endene: aminopeptidase gjennom aminoenden, og karboksypeptidase gjennom karboksylenden. Endopeptidase -enzymer utøver sin virkning inne i proteinkjeden, for eksempel: Tripsin, Pepsin, Chimotripsin, etc.
- Amidas og estere
Amidene når de varmes opp i et alkalisk medium stammer fra en karboksylsyre og en amin:
Rconh2 + H2O => rcoo- + NH2
Abvarter i et vandig medium hydrolyseres i en karboksylsyre og alkohol. Prosessen katalyseres enten av en base eller en syre:
Rco-or ' +h2O => rcooH +r'oh
Dette er den berømte forsoningreaksjonen.
- Syre-base
I vannet hydrolyseres flere arter for å surere eller alkalisere det vandige miljøet.
Tillegg av et grunnleggende salt
Natriumacetat, et grunnleggende salt, dissosierer i vann som gir naioner+ (natrium) og cho3COO- (acetat). Dets grunnleggende er fordi acetat hydrolyseres for å generere ioner oh-, Mens natrium forblir uendret:
Ch3COO- + H2Eller Ch3COOH +OH-
Det kan tjene deg: metylsalisylatÅH- Han er ansvarlig for at pH skal øke og bli grunnleggende.
Tilsetning av et syresalt
Ammoniumklorid (NH4Cl) dannes av kloridionet (cl-) fra saltsyre (HCl), en sterk syre og ammoniumkation (NH4+) fra ammoniumhydroksyd (NH4Å), en svak base. CL- Den dissosierer ikke i vann, men ammoniumkationen blir transformert til vannet på følgende måte:
NH4+ + H2Eller NH3 + H3ENTEN+
Hydrolysen av ammoniumkation produserer protoner som øker surheten til et vandig medium, så det konkluderes med at NH4CL er et syresalt.
Tilsetning av et nøytralt salt
Natriumklorid (NaCl) er et saltprodukt av reaksjonen av en sterk base (NaOH) med en sterk syre (HCl). Når du løser opp natriumklorid i vannet, produseres natriumkationen (NA+) og anionen (CL-). Begge ionene dissosierer ikke i vannet, så de tilsetter ikke h+ eller åh-, Holder pH -pH konstant.
Derfor sies det at natriumklorid er et nøytralt salt.
Referanser
- Mathews, c. K., Van Holde, K. OG. Og Ahern, K. G. (2002). Biokjemi. (Tredje utgave). Redigere. Pearson-Addison Wesley.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Helmestine, Anne Marie, PH.D. (13. januar 2019). Hydrolyse: Definisjon og eksempel. Gjenopprettet fra: Thoughtco.com
- Theresa Phillips. (28. april 2019). En forklaring av prosessen med hydrolyse. Gjenopprettet fra: TheBalance.com
- Redaktørene av Enyclopaedia Britannica. (16. november 2016). Hydrolyse. Encyclopædia Britannica. Gjenopprettet fra: Britannica.com
- Wikipedia. (2019). Hydrolyse. Hentet fra: i.Wikipedia.org
- « Hyracoteriumegenskaper, ernæring, arter, reproduksjon
- Historie om opprinnelse videospill til virtual reality »

