Aluminiumhydrid (ALH3) struktur, egenskaper, bruk
- 1678
- 18
- Jonathan Carlsen
Han Aluminiumhydrid Det er en uorganisk forbindelse med kjemisk formel er ALH3. Selv om det virker av en enkel karakter, er det faktisk et noe intrikat stoff. På grunn av den krystallinske lysstyrken som kan oppstå i dets faste stoff, blir den vanligvis tatt som et ionisk hydrid, dannet av ioner til3+ og h-.
Egenskapene viser imidlertid noe annet: det er et polymert faststoff, hvis mest trofaste representasjon vil være av typen (ALH3)n, å være n Antall monomere enheter ALH3 som ville integrere en glasskjede eller lag. Derfor Alh3 Det er en av de polymerene som klarer å ta i bruk en krystallinsk struktur.
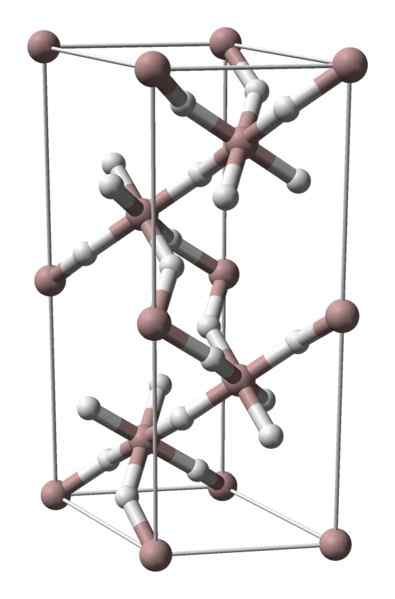 Krystallinsk struktur av aluminiumhydrid. Kilde: Benjah-BMM27 / Public Domain
Krystallinsk struktur av aluminiumhydrid. Kilde: Benjah-BMM27 / Public Domain Aluminiumhydrid er ikke et fast stoff med mye kommersiell diffusjon, så de tilgjengelige bildene av det er knappe. Det brukes spesielt til organisk syntese, der det fungerer som et kraftig reduksjonsmiddel. Det inntar også en spesiell plass i det teknologiske fremskritt av materialer, og er et lovende alternativ for hydrogenlagring.
Denne forbindelsen, også kalt Alano, holder et nært forhold til Lialh4, hvis navn er aluminium og litiumhydrid, litiumalanat eller litiumtrahydroaluminering. Selv om den har polymeregenskaper og en termisk metastabilitet, forekommer den i syv polymorfer med forskjellige krystallinske morfologier.
[TOC]
Struktur
Koordinasjoner
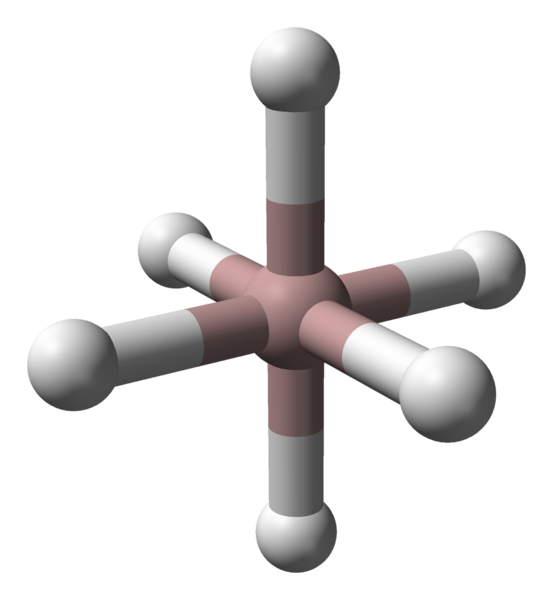
 Oktaedrisk koordinering av aluminiumskationer i ALH3 -krystallen. Kilde: Benjah-BMM27 / Public Domain.
Oktaedrisk koordinering av aluminiumskationer i ALH3 -krystallen. Kilde: Benjah-BMM27 / Public Domain. Uansett polymorf eller den krystallinske fasen er koordinasjonen mellom aluminium og hydrogenatomer konstant. I det øvre bildet, for eksempel, som i det første bildet, vises koordinering oktaedronen for aluminiumatomer (brun sfære) i det første bildet.
Kan tjene deg: støkiometriske loverHvert atom er omgitt av seks timer, og etablerer seks al-H-koblinger. Måten octaedra er orientert i verdensrommet vil utgjøre den strukturelle forskjellen mellom en polymorf og en annen.
På den annen side er hvert H-atom koordinert med to atomer Al, og etablerer en Al-H-AL-binding, som kan rettferdiggjøres med en kobling på 3C2E-type (3 Centers-2-elektroner). Denne lenken er ansvarlig for å bli med i flere octaedros alh6 Gjennom hele Alano Crystal.
Isolert molekyl
Alh3 Det regnes som polymert på grunn av ALH -nettverk6 som integrerer glasset. For å isolere et individuelt Alano -molekyl, er det nødvendig å bruke lave trykk i en inert atmosfære av edelgass. På denne måten bryter og frigjør polymeren ALH -molekyler3 av trigonal flat geometri (analog med BH3).
På den annen side er det mulig å redusere to ALH3 å danne a2H6, Som med Diborano, B2H6. For å oppnå dette er det imidlertid nødvendig med bruk av fast hydrogen, så det kan ikke ha mye industriell eller kommersiell langvarig verdi.
Polymorfer
Alano eller Alh3 Den er i stand til å danne opptil syv polymorfer: α, α ', β, γ, Δ, ε og ζ, hvorav α er den mest stabile til temperaturendringer. A-alh3 Det kjennetegnes ved å ha en kubisk morfologi og en sekskantet krystallinsk struktur. Det har en tendens til å være produktet der de andre polymorfene blir transformert når de lider av termisk destabilisering.
Morfologien til y-alh3, På den annen side skiller det seg ut for å være av nåler -type. Det er grunnen til at ALH3 Fast kan inneholde en blanding av mer enn to polymorfer, og presentere varierte krystaller til mikroskopet.
Egenskaper
Fysisk utseende
Aluminiumhydrid er et fargeløst eller hvitaktig fast, krystallinsk utseende med en tendens til å vise nålformer.
Kan tjene deg: sulfonsyre: struktur, nomenklatur, egenskaper, brukMolmasse
29.99 g/mol o 30 g/mol
Smeltepunkt
150 ºC. Men det begynner å bryte fra 105 ° C.
Vannløselighet
Høy, reagerer deretter med henne.
Løselighet
Uoppløselig i diethyléter og apolare løsningsmidler som benzen og pentan. Reagerer med alkoholer og andre polare løsningsmidler.
Nedbrytning
Alh3 Det er utsatt for nedbrytning i forskjellige hastigheter avhengig av de ytre forholdene, for morfologien og termisk stabilitet av krystaller, eller bruk av katalysatorer. Når det gjør det, frigjør det hydrogen og forvandles til metallaluminium:
2alh3 → 2AL + 3H2
Faktisk representerer denne nedbrytningen i stedet for å være et problem, en av grunnene til at Alano anses som interessant i utviklingen av nye energiteknologier.
Adduktdannelse
Når Alh3 Den reagerer ikke med løsningsmidlet irreversibelt, det etablerer et addukt med det, det vil si en type kompleks. For eksempel kan du danne et kompleks med trimetylamin, ALH3· 2n (Cho3)3, Med tetrahydrofurano, alh3· THF, eller med diettileter, ALH3· Et2ENTEN. Sistnevnte var den mest kjente da syntesen eller å skaffe Alano ble introdusert i 1947.
Å skaffe
De første opptredenene av ALH3 De dateres tilbake til 1942 og 1947, og var dette i fjor da syntesen ble presentert ved hjelp av Lialh4 I et dietylmedium:
3lialh4 + Alcl3+ nEt2O → 4alh3 · nEt2O + 3licl
Den eteriske løsningen, alh3 · nEt2Eller, han måtte underkaste seg å skuffe, med det formål å eliminere ET2Eller og få ALH3 ren. I tillegg til dette problemet, bør LICL elimineres fra mediet til produktene.
Fra 1950 til 1977 ble ny syntese designet for å oppnå bedre ALH -avkastning3, samt reneste faste stoffer og bedre termiske og morfologiske egenskaper. Endre mengder, trinn og instrumenter som brukes, er det mulig å favorisere å skaffe en polymorf over den andre. Imidlertid α-Alh3 Det er vanligvis flertallsproduktet.
Det kan tjene deg: Alilo: Allyic Unit, Carbocation, Radical, EksemplerAndre syntesemetoder består av å bruke elektrokjemi. For å gjøre dette brukes en aluminiumsanode og en platina -katode. I anoden passerer følgende reaksjon:
3alh4- + Til3+ + nThf → 4alh3 · nThf + 3e-
Mens i katodens metallisk natrium oppnås. Så Alh3 · nTHF gjennomgår også desillowing for å eliminere THF og til slutt få ALH3.
applikasjoner
Reduksjonsmiddel
Alh3 Det tjener til å redusere visse funksjonelle grupper av organiske forbindelser som karboksylsyrer, ketoner, aldehyder og estere. Praktisk talt det det gjør er å legge til hydrogener. For eksempel kan en ster reduseres til en alkohol i nærvær av en nitrogruppe:
 Reduksjon av en ster med aluminiumhydrid. Kilde: Ingefær / offentlig domene.
Reduksjon av en ster med aluminiumhydrid. Kilde: Ingefær / offentlig domene. Hydrogenreservoar
Aluminiumhydrid representerer et alternativ til å tjene som et hydrogenreservoar, og dermed, for å kunne dispensere det portabelt i enheter som fungerer med hydrogenbatterier. Volumene oppnådd fra h2 samsvarer med et større volum på dobbel enn ALH3.
Har alh3, og nedbryt det kontrolleres, kan en viss ønskelig mengde h frigjøres2 når som helst. Derfor kan det brukes som rakettdrivstoff og alle de energiapplikasjonene som søker å dra nytte av hydrogenforbrenning.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Hydrid aluminium. Hentet fra: i.Wikipedia.org
- Nasjonalt senter for bioteknologiinformasjon. (2020). Hydrid aluminium. PubChem -database., CID = 14488. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- J. Graetz et al. (2011). Aluminiumhydrid som hydrogen og energilagringsmateriale: fortid, nåtid og fremtid. Elsevier f.V.
- Xu Bo et al. (2014). Forberedelse og termiske egenskaper til studenthydridpolymorfer. gjør jeg.org/10.1016/j.Vakuum.2013.05.009
- « Lineært variasjonskonsept, eksempler, trening løst
- Jordformen og dens fysiske og astronomiske konsekvenser »

