Holmio

- 3555
- 494
- Magnus Sander Berntsen
 Metallisk Holm Ultrapure -prøve. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)]
Metallisk Holm Ultrapure -prøve. Kilde: Hi-res Images ofchemical Elements [CC av 3.0 (https: // creativecommons.Org/lisenser/av/3.0)] Hva er Holmio?
Han Holmio Det er et metallisk element som tilhører blokken F av den periodiske tabellen, spesielt til lantaniders periode. Det er derfor medlem av de sjeldne jordene, ved siden av Erbio, Itrio, Disposio og Iterbio. Alle disse utgjør en serie mineraler (Xenotima eller Gadolinita) som er vanskelige å skille gjennom konvensjonelle kjemiske metoder.
Det kjemiske symbolet er HO, som har et atomnummer på 67, og er mindre rik enn naboens disposio (66Dy) og Erbio (68Er). Det sies da at Odddo-Harkins regler adlyder. Holmius er en av de sjeldne metallene som nesten ingen kjenner eller mistenker at dens eksistens; Selv blant kjemikalier nevnes det vanligvis ikke veldig ofte.
I medisinområdene er Holmio kjent for bruk av laseren sin i operasjoner for å bekjempe prostatapatologier. Det representerer også det lovende materialet for fremstilling av elektromagneter og kvantedatamaskiner, på grunn av dets uvanlige magnetiske egenskaper.
Holmiumforbindelser, trivalent, ho3+, De presenterer særegenheten ved å utvise en farge avhengig av lyset de er Irradie. Hvis dette er lysstoffrør, endres fargen på disse forbindelsene fra gult til rosa. Tilsvarende skjer det med sine løsninger.
Historie
Oppdagelsen av Holmio tilskrives to sveitsiske kjemikalier, Marc DeFontaine og Jacques-Louis Soret, som i 1878 ble oppdaget spektroskopisk mens de analyserte i Genève-mineraler av sjeldne jordarter. De kalte ham element x.
Bare et år senere, i 1879, klarte den svenske kjemikeren per Teodor Cleve2ENTEN3). Dette oksidet, forurenset av andre urenheter, viste en brun farge, som han kalte 'Holmia', som betyr hjerneslag på latin.
Kan tjene deg: eksergonisk reaksjon: egenskaper og eksemplerCleve oppnådde også et annet grønt materiale: 'Thulia', som blir tuliooksid. Problemet med denne oppdagelsen er at ingen av de tre kjemikaliene kunne oppnå en tilstrekkelig prøve ren av Holm -oksydet, siden det var forurenset av Docch -atomer, et annet lantanidmetall.
Det var ikke annet enn i 1886 at det franske kjemikaliet, Paul Lecoq fra Boisbaudran, isolerte Holm -oksydet ved fraksjonert nedbør. Dette oksidet gjennomgikk deretter kjemiske reaksjoner for å produsere Holmio -salter, som ble redusert i 1911 av den svenske kjemikeren Otto Holmberg; Og så dukket de første metalliske Holm -prøvene opp.
Imidlertid for øyeblikket Holmios ioner, hol3+, De blir trukket ut ved ionebytterkromatografi, i stedet for å ty til konvensjonelle reaksjoner.
Holm -egenskaper
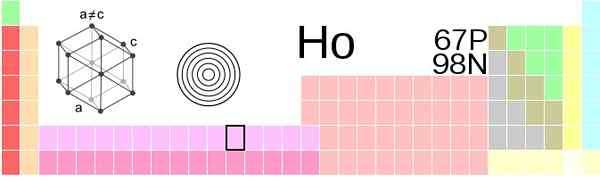 Holmio beliggenhet i det periodiske bordet. Kilde: Vektorisering: Sushant Savla 05:51, 9. juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons
Holmio beliggenhet i det periodiske bordet. Kilde: Vektorisering: Sushant Savla 05:51, 9. juni 2019 (UTC), CC BY-SA 4.0, via Wikimedia Commons Fysisk utseende
Sølv, mykt, duktilt og formbart metall.
Atomnummer
67 (67Ho)
Molmasse
164,93 g/mol
Smeltepunkt
1461 ºC
Kokepunkt
2600 ºC
Tetthet
Ved romtemperatur: 8,79 g/cm3
Akkurat når smelter eller smelter: 8,34 g/cm3
Fusjonsvarme
17 kJ/mol
Fordampningsvarme
251 kJ/mol
Molar varmekapasitet
27.15 J/(mol · K)
Elektronegativitet
1.23 på Pauling -skalaen
Ioniseringsenergier
Først: 581,0 kJ/mol (Ho+ gassform)
For det andre: 1140 kJ/mol (Ho2+ gassform)
Tredje: 2204 kJ/mol (ho3+ gassform)
Termisk ledningsevne
16.2 W/(M · K)
Elektrisk resistivitet
814 nΩ · m
Oksidasjonstall
Holm kan presenteres i sine forbindelser med følgende tall eller oksidasjonstilstander: 0, +1 (Ho+), +2 (ho2+) og +3 (ho3+). Av dem alle er +3 den desidert vanligste og stabile. Derfor er Holm et trivalent metall, og danner forbindelser (ionisk eller delvis ionisk) der det deltar som et ho -ion3+.
Kan tjene deg: etylacetatFor eksempel i følgende forbindelser finnes HOLM med +3 oksidasjonsnummer: Ho2ENTEN3 (Ho23+ENTEN32-), Ho (oh)3, Hoi3 (Ho3+Yo3-) og ho2(SW4)3.
Ho3+ Og dets elektroniske overganger er ansvarlige for forbindelsene i dette metallet ser brungul. Imidlertid, når de stråler med lysstoffrør, blir de rosa. Det samme gjelder løsningene deres.
Isotoper
Holmio presenteres i naturen som en enkelt stabil isotop: 165Ho (100% overflod). Imidlertid er det kunstige radioisotoper med betydelige halvlivstider. Mellom dem har vi:
-163Ho (t1/2 = 4570 år)
-164Ho (t1/2 = 29 minutter)
-166Ho (t1/2 = 26.763 timer)
-167Ho (t1/2 = 3,1 timer)
Magnetisk orden og øyeblikk
Holm er et paramagnetisk metall, men det kan bli ferromagnetisk ved en temperatur på 19 K, og viser veldig sterke magnetiske egenskaper. Det er preget av å ha det magnetiske øyeblikket (10,6 μB) større blant alle kjemiske elementer, samt en uvanlig magnetisk permeabilitet.
Reaktivitet
Holm er et metall som under normale forhold ikke oksy for raskt, så det tar å miste lysstyrken. Imidlertid, når han blir oppvarmet med en lighter, blir det gulaktig, produktet av dannelsen av et oksydlag:
4 ho + 3 o2 → 2 ho2ENTEN3
Reagerer med fortynnede eller konsentrerte syrer for å forårsake deres respektive salter (nitrater, sulfater, etc.). Imidlertid reagerer den ikke med fluorhorinsyre, siden et HOF -lag3 beskytter det mot nedbrytning.
Holmio reagerer også med alle halogener for å produsere sine respektive halogenuros (HOF3, Hocl3, Hobr3 og hoi3).
Kjemisk struktur
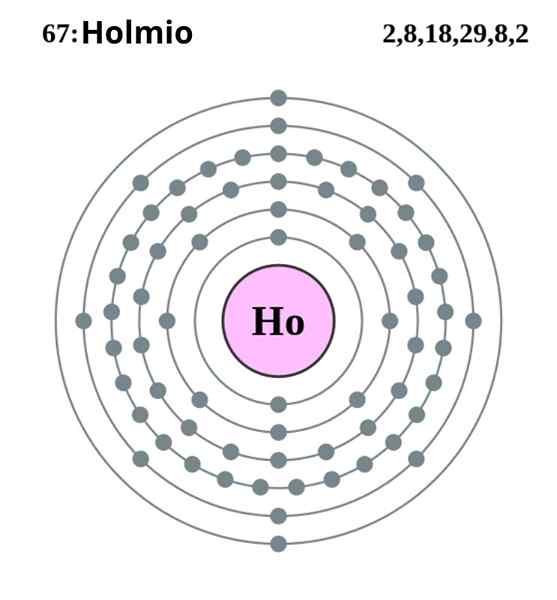 Holmio elektronisk konfigurasjon. Kilde: Pumba (originalt arbeid av Greg Robson) Creative Commons anerkjennelsesdeling under samme lisens 2.0 England og landet Wales
Holmio elektronisk konfigurasjon. Kilde: Pumba (originalt arbeid av Greg Robson) Creative Commons anerkjennelsesdeling under samme lisens 2.0 England og landet Wales Holmio krystalliserer i en kompakt sekskantet struktur, HCP (for sitt forkortelse på engelsk: tettpakket sekskantet). I teorien forblir HO -atomer sammenhengende takket være metallbindingen dannet av elektronene til deres 4F -orbitaler, i henhold til deres elektroniske konfigurasjon:
Kan tjene deg: fortynning: konsept, hvordan det gjøres, eksempler, øvelser[Xe] 4felleve 6s2
Slike interaksjoner, så vel som energisystemet til elektronene, definerer de fysiske egenskapene til Holmio. Dette metallet er ikke kjent noen annen alotrope eller polymorf, ikke engang under høyt trykk.
applikasjoner
Atomreaksjoner
Holmio -atomet er et godt nøytronabsorberende, så det hjelper med å kontrollere utviklingen av kjernefysiske reaksjoner.
Spektroskopi
Holmio Oxide Solutions brukes til å kalibrere spektrofotometre, fordi absorpsjonsspekteret deres nesten alltid gjenstår, uavhengig av urenheter den inneholder. Det viser også veldig karakteristiske akutte bånd assosiert med Holmio -atomet, og ikke til dets forbindelser.
Colorant
Holmio -atomer er i stand til å gi rødlige fargelegging til glass og kunstige perler av kubisk circumsite.
Magneter
Ved ekstremt lave temperaturer (30 K eller mindre) viser Holmius interessante magnetiske egenskaper, som brukes til å produsere kraftige elektromer, der det hjelper til med å konsentrere det resulterende magnetfeltet.
Slike magnetiske materialer er bestemt for kjernefysisk magnetisk resonans; for utvikling av harddisker, med minner som svinger i petabyte eller terabyte; og muligens å produsere kvantedatamaskiner.
Holmio Laser
En ititrio-aluminium granatkrystall (YAG) kan doping med Holmio-atomer for å avgi en stråling hvis bølgelengde er 2 um; Det vil si at vi har en Holm -laser. Takket være ham kan tumorvev kuttes nettopp uten å forårsake blødning, siden energien som leveres vekker sårene umiddelbart.
Denne laseren har blitt brukt tilbakevendende i prostata- og tannlegeringer, samt for å eliminere kreftceller og nyrestein.

