Steroidhormoner struktur, syntese, virkningsmekanisme
- 2540
- 138
- Jonathan Moe
De Steroidhormoner De er stoffer laget av interne sekresjonskjertler og som dumper direkte i sirkulasjonsstrømmen, noe som fører dem til vevene der de utøver sine fysiologiske effekter. Det generiske navnet stammer fra det faktum å ha en steroidkjerne i sin grunnleggende struktur.
Kolesterol er forløperstoffet som alle steroidhormoner er syntetisert fra, som er gruppert i progestaging (for eksempel progesteron), østrogener (stonsering), androgener (testosteron), glukokortikoid (cortisol), mineralokortikoider (aldosteron) og vitamindosol), mineralocorticoids (aldosteron) og vitamindosol), mineralocorticoids (aldosteron) og forkortisol), mineralocorticoids (aldosteron) og kortisol), mineralokortikortikoter (testosteron), glukokortikoids (cortisol), mineralokortikoteron) (.
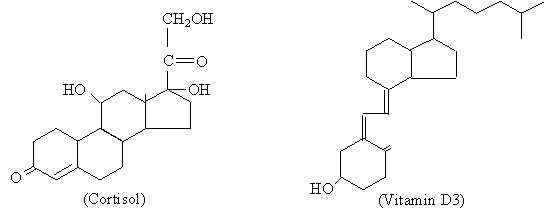
 Sammenligning av strukturen til et steroidhormon (kortisol) med et molekyl av samme kjemiske natur (vitamin D3) (kilde: Den opprinnelige opplasteren var Palladius på engelsk Wikipedia. [Public Domain] via Wikimedia Commons)
Sammenligning av strukturen til et steroidhormon (kortisol) med et molekyl av samme kjemiske natur (vitamin D3) (kilde: Den opprinnelige opplasteren var Palladius på engelsk Wikipedia. [Public Domain] via Wikimedia Commons) Selv om de forskjellige steroidhormonene har en molekylære forskjeller som er de som gir sine forskjellige funksjonelle egenskaper, kan det sies at de har en grunnleggende struktur som er felles for dem, og som er representert av cyclopentanoperhydrofenantreno av 17 karbonatomer.
[TOC]
Steroidstruktur
Steroider er organiske forbindelser av veldig mangfoldig karakter som til felles hva som kan betraktes som en stamfaderkjerne som består av fusjonen av tre ringer av seks karbonatomer (cykloheksan) og ett av fem karbonatomer (cyclopentano).
Denne strukturen er også kjent som "cyclopentanoperhydrofenantreno". Ettersom ringene er forenet gjensidig, er de totale karbonatomene som utgjør det 17; Imidlertid mest naturlig steroid.
 Ordning av de fire ringene av cyclopentanoperhidrofenantreno cycropic struktur (kilde: neurotokeker [public domain] via wikimedia commons)
Ordning av de fire ringene av cyclopentanoperhidrofenantreno cycropic struktur (kilde: neurotokeker [public domain] via wikimedia commons) Mange av de naturlige steroidforbindelsene har også en eller flere grupper med alkoholfunksjon og får derfor navnet på steroler. Blant dem er kolesterol, som har en alkoholfunksjon i karbon 3 og en lateral hydrokarbonkjede på 8 karbon -festede karbonatomer 17; Atomer som er nummerert fra 20 til 27.
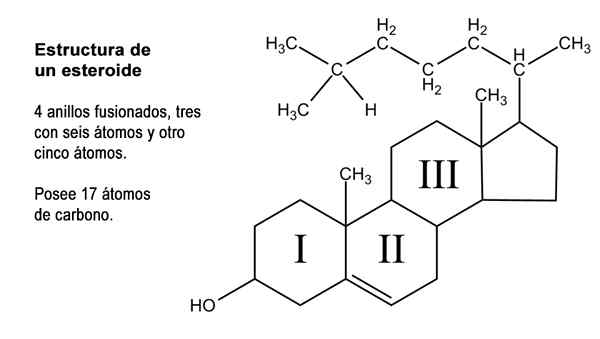 Struktur av et steroid. Modifisert bilde av Marcotolo/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5)
Struktur av et steroid. Modifisert bilde av Marcotolo/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5) I tillegg til disse 17 karbonatområdene, kan steroidhormoner ha i sin struktur 1, 2 eller 4 flere av disse atomene, så tre typer steroider blir gjenkjent, nemlig: C21, C19 og C18.
C21
C21, som progesteron og binyre kortikosteroider (glukokortikoid og mineralokortikoider), er avledet fra "gravid" ". Dette har 21 karbonatomer fordi de to av metylgruppene i karbon og 10 ved 17 av den basiske ringen tilsettes, og to karbonatomer av sidekjeden festet til C17 som opprinnelig, i kolesterolet, var 8 karbonatomer.
C19
C19 tilsvarer kjønnshormoner med androgen aktivitet og stammer fra “Androstano” (19 karbonatomer), som er strukturen som gjenstår når gravan mister de to karbonene i sidekjeden til C17, som erstattes av en hydroksyl eller hydroksyl en ketonisk gruppe.
C18
C18 -steroidene er kvinnelige eller østrogenhormoner som hovedsakelig er syntetisert i kvinnelige gonader og hvis fremtredende karakteristikk, med hensyn til de to andre typene steroider, er fraværet av metyl som er til stede i sistnevnte bundet til karbon i posisjon 10.
Under syntesen fra kolesterol produseres enzymatiske modifikasjoner som endrer antall karbonatomer og fremmer dehydrogenering og hydroksilasjoner av spesifikke karbonatomer i strukturen.
Syntese
Steroidhormonproduserende celler er hovedsakelig lokalisert i barken til binyrene, hvor glukokortikoider som kortisol, mineralokortikoider som aldosteron og mannlige kjønnshormoner som dehydroepiandrosteron og androsteneda.
Mannlige seksuelle gonader er ansvarlige for produksjon av androgener som inkluderer hormonene som allerede er nevnt og testosteron, mens eggstokksekkene som når modning produserer progesteron og østrogen.
Kan tjene deg: Halvparten av meg: Hva er, grunnlag, forberedelse, brukerSyntesen av alle steroidhormoner begynner fra kolesterol. Dette molekylet kan syntetiseres av steroidhormoner som produserer celler, men stort sett oppnår disse cellene fra lipoproteiner med lav tetthet (LDL) i det sirkulerende plasma.
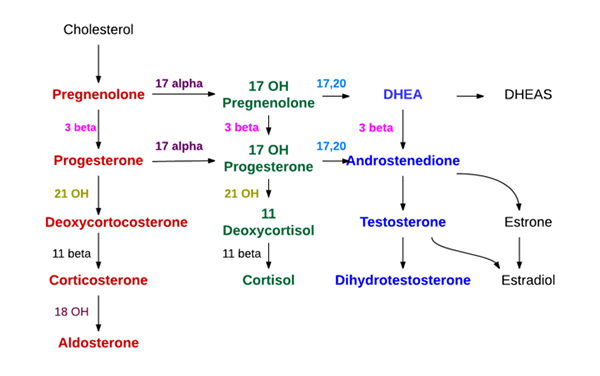 Syntese av binyrehormoner (kilde: Endokrin lege [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons)
Syntese av binyrehormoner (kilde: Endokrin lege [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)] via Wikimedia Commons) - Syntese på binyrebarknivå
Tre lag skilles ut i binyrebarken, kjent utenfra som henholdsvis glomerulære, fascikulære og retikulære områder.
I glomerulær syntetiserte de grunnleggende mineralokortikoider (aldosteron), i de fascikulære glukokortikoider som kortikosteron og kortisol, og i retikulære androgener som dehydroepiandrosteron og androsten.
Glukokortikoidsyntese
The first step in the synthesis occurs in the mitochondria and consists in the action of an enzyme called cholesterol demollase, belonging to the superfamily of the cytochrome P450 and also known as "P450SCC" or "CyP11A1", which promotes the elimination of 6 of The Karbonatomer i sidekjeden festet til C17.
Med virkningen av demolase blir kolesterol (27 karbonatomer) en gravanolon, som er en forbindelse med 21 karbonatomer og representerer den første av steroider av type C21.
Begrensningenolon beveger seg til den glatte endoplasmatiske retikulum, hvor ved handling av enzymet 3β-hydroxiesteroid dehydrogenase.
Ved virkningen av 21β-hydroksylase, også kalt “P450C21” eller “CYP21A2”, er progesteronet hydroxyle i karbon 21 og transformerer seg til 11-di-dixorticosteron, som vender tilbake til mitokondriene, og som enzymet 11β-Hydroxylase ("" "" P450C11 ”eller“ CYP11B1 ”) konverterer til kortikosteron.
En annen syntese i den fascikulære sonen og som ikke ender i kortikosteron, men i kortisol, oppstår når gravanolon eller progesteron hydroksyleres i posisjon 17 ved 17a-hydroksylase (“P450C17” eller “CYP17” og konverteres til 17-HydroxipNenolononolone eller 17-hydroxiprgesteron.
Det samme enzymet som allerede er nevnt, dehydrogenase av 3β-hydroxiesteroider, som konverterer gravenolon til progesteron, konverterer også 17-hydroxipnenolon i 17-hydroxiprgesteron.
Det siste bæres suksessivt, av de to siste enzymer av veien som produserer kortikosteron (21β-hydroksylase og 11β-hydroksylase) til henholdsvis deoxyxicortisol og kortisol.
Glukokortikoidhandlinger
De viktigste glukokortikoider produsert i fascikulær sonen til binyren er kortikosteron og kortisol. Begge stoffene, men spesielt kortisol, viser et bredt spekter av handlinger som påvirker metabolisme, blod, forsvar og sårheling, beinmineralisering, fordøyelseskanalen, sirkulasjonssystemet og lungene.
Når det gjelder metabolisme, stimulerer kortisol lipolyse og frigjøring av fettsyrer som kan brukes i leveren for dannelse av ketonlegemer med lav tetthet (LDL); reduserer glukosesamling og lipogenese i fettvev og samling og bruk av glukose i muskelen.
Det fremmer også proteinkatabolisme i periferien: i kontaktvevet, muskelen og beinmatrisen, som frigjøres aminosyrer som kan brukes i leveren for syntese av plasmaproteiner og for glukoneogenese. Stimulerer i tillegg tarmglukoseabsorpsjon ved å øke produksjonen av SGLT1 -transportører.
Akselerer glukose tarmabsorpsjon, forsterket leverproduksjon og redusert bruk av dette karbohydratet i muskel og fettvev favoriserer en høyde av plasmaglukosenivåer.
Når det. Det hemmer også frigjøring av betennelsesformidlere som prostaglandiner, interleukiner, lymfokiner, histamin og serotonin.
Kan tjene deg: ChemiorreceptorGenerelt kan det sies at glukokortikoider forstyrrer immunresponsen, slik at de kan brukes terapeutisk i de tilfellene der denne responsen er overdrevet eller upassende, som for autoimmune sykdommer eller i organtransplantasjoner for å redusere avvisning.
- Androgensyntese
Androgen syntese på binyrene er hovedsakelig på nivå med retikulær sone og fra 17-hydroksipregneolon og 17-hydroxiprgesteron.
Det samme enzymet 17a-hydroksylase, som produserer de to ny nevnte stoffene, har også 17,20 LIASA-aktivitet, som undertrykker de to karbonatområdene i sidekjeden på C17 og erstatter dem med en Keto-gruppe (= O).
Denne siste handlingen reduserer antall karbonatomer og produserer steroider av type C19. Hvis handlingen skjer på 17- hydroxipnenolon, er resultatet dehydroepiandrosteron; Hvis det motsatte er det berørte stoffet hydroxiprgesteron, vil produktet være androsten.
Begge forbindelsene er en del av de såkalte 17-zosteroider, ettersom de har en ketongruppe i Carbon 17.
3β-hydroxisteroid dehygenase konverterer også dehydroepiandrosteron i androsten.
Mineralocorticoid Synthesis (aldosteron)
Den glomerulære sonen mangler enzymet 17α-hydroksylase, og kan ikke syntetisere de 17-hydroxiesteroidforløpere av kortisol og kjønnshormoner. Den har heller ikke 11β-hydroksylase, men et enzym kalt aldosteron synthesase som kan produsere sekvensielt kortikosteron, 18-hydroksykorisk og aldosteronmineralokortikoid.
Mineralocorticoid handlinger
Det viktigste mineralokortikoidet er det syntetiserte aldosteronet i det glomerulære området av binyrebarken, men glukokortikoider viser også mineralokortikoidaktivitet.
Aldosteronmineralokortikoidaktiviteten er utviklet på nivået av det rørformede epitelet til de distale nefron kroppsvæskene.
- Syntese av mannlige kjønnssteroider i testiklene
Androgen testikulær syntese skjer på Leydig -cellernivå. Testosteron er det viktigste androgene hormonet produsert i testiklene. Dens syntese innebærer den innledende produksjonen av androstenediona som tidligere beskrevet for syntese av androgener på nivået av binyren cortex.
Androsteneciona omdannes til testosteron ved virkning av enzymet 17β-hydroxiesteroid dehydrogenase, som erstatter ketongruppen av karbon 17 med en hydroksylgruppe (OH).
I noen vev som fungerer som et mål for testosteron, reduseres dette med en 5a-reduktase til dihydrotestosteron, med større androgen kraft.
- Syntese av kvinnelige kjønnssteroider i eggstokkene
Denne syntesen forekommer syklisk medfølgende endringene som skjer under den kvinnelige seksuelle syklusen. Syntesen forekommer i follikkelen som under hver modne syklus for å frigjøre et egg og deretter produsere den tilsvarende luteumkroppen.
Østrogener syntetiseres i de kornete cellene i den modne follikkelen. Den modne follikkelen har celler i teak som produserer androgener som androstenediona og testosteron.
Disse hormonene spredte seg til de nærliggende granøse cellene, som har aromatase-enzymet som gjør dem til stonsering (E1) og 17β-Stradiol (E2). Fra begge er Striol syntetisert.
Handlinger av sexsteroider
Andogener og østrogener har som hovedfunksjon utviklingen av henholdsvis mannlige og kvinnelige seksuelle karakterer. Andogener har anabole effekter som fremmer syntese av strukturelle proteiner, mens østrogener favoriserer ossifiseringsprosessen.
Østrogener og progesteron som frigjøres under den kvinnelige seksuelle syklusen er rettet mot.
Kan tjene deg: Flora og fauna av Baja California SurVirkningsmekanismen
Hvis du trenger å oppdatere minnet om mekanismen for hormonhandling, anbefales det å visualisere følgende video før du fortsetter.
Virkningsmekanismen til steroidhormoner er ganske lik i dem alle. Når det.
Når hormon-mottakerkomplekset er dannet, krysser det kjernemembranen og blir med i genomet, på samme måte som en transkripsjonsfaktor, med et element av respons på hormonet (HRE) eller primær responsgen, som for det kan du regulere Andre sekundære responsgener.
Det endelige resultatet er promotering av transkripsjon og syntese av RNA -budbringere som blir oversatt til ribosomene til det grove endoplasmatiske retikulum som ender opp med å syntetisere de hormoninduserte proteiner.
Aldosteron som eksempel
 Aldosteronmolekyl
Aldosteronmolekyl Virkningen av aldosteronet utøves hovedsakelig på nivå med den endelige delen av det distale røret og i samlekanalene, der hormonet fremmer reabsorpsjonen av Na+ og sekresjonen av k+.
I luminalmembranen til de viktigste rørformede cellene i denne regionen er det epitelkanaler av Na+ og K+ kanaler av den engelske typen (fra engelsk Renal ytre medullær kaliumkanal).
Den basolaterale membranen har Na+/K+ ATPASA -pumper som kontinuerlig tar Na+ fra cellen til det basolaterale interstitielle rommet og introduserer K+ i det indre av cellen. Denne aktiviteten holder den intracellulære konsentrasjonen av Na+ veldig lav og favoriserer etableringen av en konsentrasjonsgradient for dette ionet mellom lysets lys og cellen.
Denne gradienten lar Na+ bevege seg mot cellen gjennom epitelkanalen, og når Na+ passerer alene, for hvert ion som beveger seg, er det en ukompensert negativ belastning som får lyset fra tubulus til å bli negativ med hensyn til interstitium. Det vil si at en pitelial potensialforskjell skapes med det negative lyset.
Denne negativiteten av lyset favoriserer avkjørselen til K+ som beveget seg av dens større konsentrasjon i cellen, og negativiteten til lyset skilles ut mot lysets lys for å bli utskilt. Det er denne Na+ resorpsjonsaktiviteten og sekresjonen av K+ som er regulert av virkningen av aldosteron.
Aldosteronet som er til stede i blod og frigjort fra den glomerulære sonen som respons på virkningen av angiotensin II, eller på hyperkalemi, trenger inn i hovedcellene og blir sammen med dens intracitoplasmatiske reseptor.
Dette komplekset når kjernen og fremmer transkripsjonen av genene hvis uttrykk vil ende opp med å øke syntesen og aktiviteten til Na+/K+-pumpene, av Na+epitelkanalene og ROMK -kanalene til K+, så vel som andre proteiner mer. Svar som vil ha oppbevaring av Na+ i organismen og økningen i urinutskillelse av K+.
Referanser
- Ganong WF: The Adrenal Medulla & Adrenal Cortex, 25. Ed. New York, McGraw-Hill Education, 2016.
- Guyton AC, Hall JE: Adrenokortikale hormoner, i Lærebok for medisinsk fysiologi , 13. utg, AC Guyton, JE Hall (eds). Philadelphia, Elsevier Inc., 2016.
- Lang F, Verrey F: Hormon, i Physiologie des Menschen Mite Pathophysiologie, 31. Ed, RF Schmidt et al (eds). Heidelberg, Springer Medizin Verlag, 2010.
- Voigt K: Endokrines System, i: Physiologie, 6. utg; R Klinke et al (Eds). Stuttgart, Georg Thieme Verlag, 2010.
- Widmaier EP, Raph H og Strang KT: Kvinnelig reproduktiv fysiologi, i Vanders menneskelige fysiologi: Mekanismene for kroppsfunksjon, 13. utg; EP Widmaier et al (Eds). New York, McGraw-Hill, 2014.
- « Statisk friksjonskoeffisient, eksempel, trening
- Ampère formel og ligningsrett, demonstrasjon, øvelser »

