Indianer

- 3311
- 277
- Prof. Theodor Gran
 Metallisk indisk stykke. Kilde: Hi-res Images ofchemical Elements [CC av (https: // creativeCommons.Org/lisenser/av/3.0)]
Metallisk indisk stykke. Kilde: Hi-res Images ofchemical Elements [CC av (https: // creativeCommons.Org/lisenser/av/3.0)] Hva er indianeren?
Han Indianer Det er et metall som tilhører gruppe 13 i det periodiske bordet og har et kjemisk symbol i. Atomnummeret ditt er 49, 49I, og presenteres i naturen som to isotoper: 113I og 115I, sistnevnte er den mest tallrike. På jorden blir indiske atomer funnet som urenheter i sink og blymineraler.
Det er et bestemt metall, siden det er det mykeste som kan berøres uten mange helserisikoer; I motsetning til litium og rubidium, som ville forbrenne huden veldig når du reagerer med fuktigheten. Et stykke indianer kan kuttes med en kniv og brudd med fingers kraft, og avgir en særegen knase.
Den som hører om dette metallet, vil sikkert komme til tankene India, men navnet hans stammer fra Indigo Color, som blir observert når flammetesten utføres. I denne forstand ser det ganske mye kalium ut, og brenner metallet eller forbindelsene med en veldig karakteristisk flamme, som indianeren ble oppdaget for første gang i Sphenset -mineraler.
Indianen deler mange kjemiske egenskaper med aluminium og gallium, og presenterer i de fleste forbindelser med et oksidasjonsnummer på +3 (i3+). Den kombinerer utmerket med Gallia som danner legeringer med lave smeltepunkter, en av dem er Galinstan.
Indiske applikasjoner er basert på fôr av materialer med legeringene sine, noe som gjør dem til elektriske og fleksible ledere. Indianen har litt glass for å gi dem større glitter, og erstatter sølvet. I teknologiens verden finnes indianeren på berøringsskjermene og LCD.
Oppdagelse
I 1863 lette den tyske kjemikeren Ferdinand Reich etter spor av Talio -elementet, ved å bruke den grønne linjen til dets emisjonsspekter, i Cinc -mineraler; Spesielt prøver av sfaleritt (Zns) rundt Sachsen. Etter å ha ristet mineralene, fjern svovelinnholdet, fordøy dem i saltsyre og destill.
Gitt funnet, bestemte Reich seg for å utføre en spektroskopisk analyse; Men fordi han ikke hadde gode øyne til å observere fargene, gikk han til kollegaen Hariomus Theodor Richter for å hjelpe ham i denne oppgaven. Richter var den som observerte en blåaktig spektral linje, som ikke stemte overens med spekteret av noe annet element.
Det kan tjene deg: Jodosesyre (HIO2): Egenskaper og bruksområderDe to tyske kjemikerne sto overfor et nytt element, som ble kalt den indiske fargen for indigo -fargen på flammen da forbindelsene deres brant; Og på sin side stammer navnet på denne fargen fra det latinske ordet Indikum, Hva betyr India.
Et år senere, i 1864, spent og etter en langvarig serie med nedbør og rensinger, isolerte de en prøve av metallisk indianer gjennom elektrolyse av deres oppløste salter i vann.
Indisk struktur
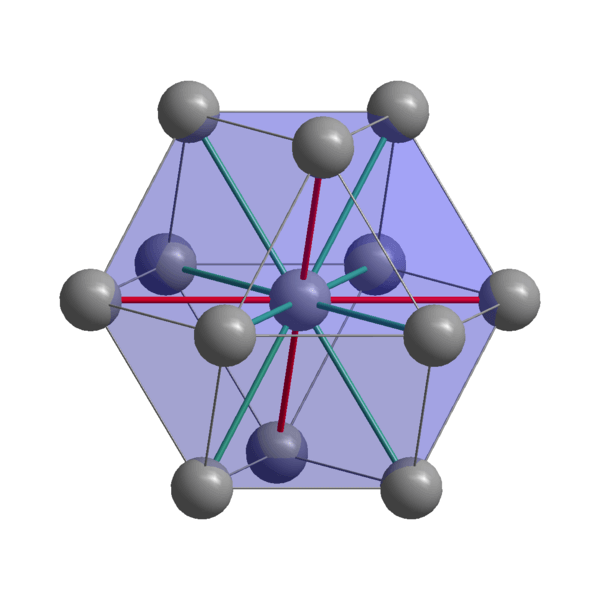 Indisk krystallinsk struktur
Indisk krystallinsk struktur Indiske, i, kohesjon atomer ved bruk av valenselektronene sine for å etablere en metallbinding. Dermed ender de opp med å bli bestilt i en forvrengt tetragonal struktur sentrert på kroppen. Interaksjonene mellom in-in-in-Neighbor-atomer er relativt svake, noe som forklarer hvorfor indianeren har et lavt smeltepunkt (156 ºC).
På den annen side er ikke kreftene som forener seg to eller flere indiske krystaller heller sterke, ellers ville de ikke bevege seg oppå hverandre, og gi metallets karakteristiske mykhet.
Indiske eiendommer
Fysisk utseende
Det er et bemerkelsesverdig mykt sølvmetall. Den kan rive med trykket fra neglen, kuttet med en kniv eller skrape i lyse slag på et papirark. Det er til og med mulig å tygge den og deformere den med tennene, forutsatt at den er flatet. Det er også veldig duktil og formbar, med plastegenskaper.
Når indianeren varmet opp med en fakkel avfeier en flamme av en indigo -farge, enda lysere og mer fargerik enn kalium.
Molmasse
114,81 g/mol
Smeltepunkt
156,60 ºC
Kokepunkt
2072 ºC.
I likhet med Gallia har indianeren et stort temperaturintervall mellom fusjonspunktet og kokingen. Dette gjenspeiler det faktum at in-in-interaksjonene i væsken er sterkere enn de som dominerer i glasset; Og derfor er det lettere å få en dråpe indianer enn damper.
 Indisk beliggenhet i det periodiske bordet. Kilde: Daniel Mayer eller Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons
Indisk beliggenhet i det periodiske bordet. Kilde: Daniel Mayer eller Greatpatton Vectorization: Sushant Savla, CC BY-SA 3.0, via Wikimedia Commons Tetthet
Ved romtemperatur: 7,31 g/cm3
Rett ved smeltepunktet: 7,02 g/cm3
Elektronegativitet
1.78 på Pauling -skalaen
Ioniseringsenergier
Først: 558,3 kJ/mol
Andre: 1820,7 kJ/mol
Tredje: 2704 kJ/mol
Termisk ledningsevne
81,8 w/(m · k)
Elektrisk resistivitet
83,7 nΩ · m
Mohs hardhet
1.2. Det er knapt litt vanskeligere enn talkum (ikke forvirrende iherdighet hardt).
Reaktivitet
Indianen oppløses i syrer for å forårsake salter, men oppløses ikke i alkaliske løsninger, selv med varmt kaliumhydroksyd. Reagerer i direkte kontakt med svovel, oksygen og halogener.
Kan tjene deg: fortynning: konsept, hvordan det gjøres, eksempler, øvelserIndianeren er relativt amfoterisk, men oppfører seg mer som grunnlag enn som syre, og er dens litt grunnleggende vandige oppløsninger. In (OH)3 Det er reduserer med tillegg av flere alkalier som forårsaker indiate komplekser, i (OH)4-, Som med aluminater.
Elektronisk konfigurasjon
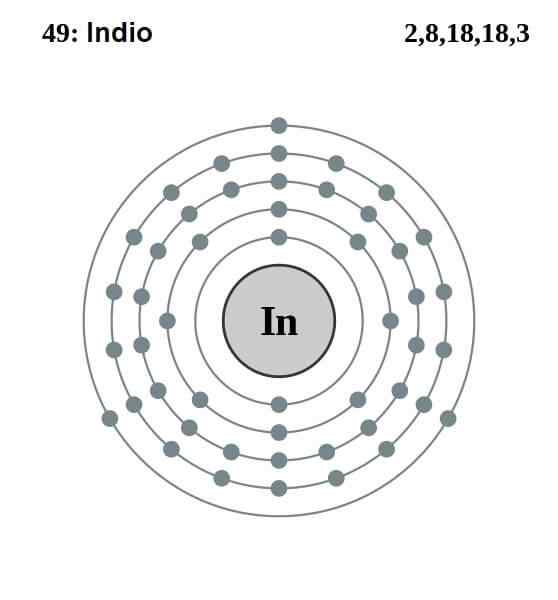 Elektronisk indisk konfigurasjon
Elektronisk indisk konfigurasjon Den elektroniske konfigurasjonen av indianeren er som følger:
[Kr] 4d10 5s2 5 s1
Av de tretten elektronene er de tre siste av 5S og 5P orbitaler de fra Valencia. Med disse tre elektronene etablerer indiske atomer sin metallbinding, som aluminium og gallium gjør, og danner kovalente bindinger med andre atomer.
Oksidasjonstall
Ovennevnte brukes til å stå på en gang at indianeren er i stand til å miste sine tre elektroner i Valencia, eller vinne fem for å bli isolektronisk for edelgass Xenon.
Hvis vi i en forbindelse antar at den har mistet sine tre elektroner, vil det forbli som den trivalente kationen i3+ (I analogi Al3+ og Ga3+) og derfor vil oksidasjonsnummeret ditt være +3. De fleste indiske forbindelser er i (III).
Blant andre oksidasjonstall som er funnet for indianeren vi har: -5 (i5-), -2 (i2-), -1 (i-), +1 (i+) og +2 (i2+).
Noen eksempler på forbindelser i (i) er: inf, inkl, inbr, ini og i2ENTEN. Alle av dem er relativt sjeldne forbindelser, mens de av i (iii) er de dominerende: i (OH)3, I2ENTEN3, Inkl3, Inf3, etc.
I (i) forbindelser er kraftige reduksjonsmidler, der inn+ donere to elektroner til andre arter for å bli i3+.
Isotoper
Indianeren blir presentert i naturen som to isotoper: 113I og 115I, hvis landforekomster er henholdsvis 4,28% og 95,72%. Derfor har vi på jorden mange flere atomer av 115I den av 113I. Han 115I har en halvliv på 4,41 · 1014 år, så flott at det praktisk talt anses som stabilt, til tross for at han er radioisotop.
For tiden er totalt 37 kunstige isotoper av indiske, alle radioaktive og veldig ustabile blitt opprettet. Av dem alle er den mest stabile 111I, som har en halvliv på 2,8 dager.
Bruk/applikasjoner
Legeringer
Indianeren kommer veldig godt overens med gallium. Begge metaller danner legeringer som mel. Også indianeren er også lett amalgam, og har en 57% løselighet i kvikksølv.
Kan tjene deg: eddiksyre (CH3COOH)Indiske legeringer brukes til å designe sølvspeil uten å ty til sølv. Når de helles på et område av noe materiale, fungerer det som en tilhenger, slik at glass, metall, kvarts og keramikk kan samles.
Elektronikk
 Uten indianeren ville berøringsskjermene aldri ha eksistert
Uten indianeren ville berøringsskjermene aldri ha eksistert Indianeren kommer også sammen med Germanio, så forbindelsene hans tilsettes som doping til den germanske nitruroen til lysdiodene, og reproduserer disse blandingene blå lys, lilla og grønn. Det er også en del av transistorene, termistorene og fotovoltaiske celler.
Det viktigste av forbindelsene er tinn og indisk oksid, som brukes som et glassfor for å gjenspeile noen bølgelengder. Dette lar deg brukes i sveisebriller, og i skrapglasset slik at de ikke varmer inni.
Glass belagt med dette oksydet er gode strømledere; Som den fra fingrene. Og det er derfor det er bestemt for fremstilling av berøringsskjermer, enda mer aktuell aktivitet på grunn av fremveksten av flere og flere smarttelefoner.
Risiko
 Indian i solid stat. Kilde: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons
Indian i solid stat. Kilde: w. Oelen, CC BY-SA 3.0, via Wikimedia Commons Indianeren representerer ikke noen risiko for miljøet i første omgang, som det i ioner i3+ De formidles ikke i betydelige mengder. Det er ingen informasjon om hva dets innvirkning på jordsmonnene vil være, påvirke planter og verken i fauna eller hav.
I kroppen er det ukjent om ionene i3+ De har en viss essensiell deltakelse i metabolisme i spormengder. Imidlertid, når forbindelsene deres blir inntatt, er de skadelige for flere organer, og det er grunnen til at de anses som svært giftige stoffer.
Ito -partikler (tinn og indisk oksid, for sitt forkortelse på engelsk: Indiumtinnoksid), uunnværlig for fremstilling av skjermer for datamaskiner og smarttelefoner, kan de påvirke arbeidernes helse negativt, og forårsake dem en sykdom som kalles indiske lunger.
Inntaket av disse partiklene skjer fremfor alt ved innånding og ved kontakt gjennom huden og øynene.
På den annen side er fine metalliske indiske partikler utsatt for å brenne og forårsake branner hvis de er gjerder en varmekilde.

