Hydronio ion
- 1641
- 453
- Jonathan Moe
Hva er hydroniumionet?
Han Hydronio ion Det er en slags positiv belastning som skyldes protonering av et vannmolekyl, og hvis kjemiske formel er h3ENTEN+. Den består av de enkleste av oksonians: ioner der oksygen har en positiv formell belastning og har tre kovalente bindinger.
H3ENTEN+ Det er en av de enkleste, men nysgjerrige kationene som finnes. Under vann under normale forhold har den en konsentrasjon på 1 · 10-7 M, produkt av selvordningsbalansen. Imidlertid øker konsentrasjonen eksponentielt når den er sterk3ENTEN+ De oppløses i vannet og forsurende det.
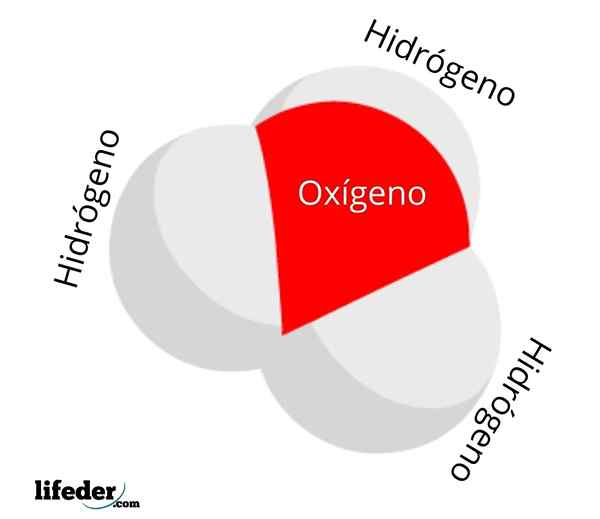
 Hydroniumionmolekyl
Hydroniumionmolekyl Konsentrasjonen eller aktiviteten til H3ENTEN+ I vannet tjener det til å måle surheten i de vandige oppløsningene: pH. Jo flere H -ioner3ENTEN+ Høy, mindre positiv vil være pH, og mer syre vil være den aktuelle løsningen. Denne surheten, derimot, ligger i hydrogenionet, h+, som ofte forveksles med ion H3ENTEN+.
 Ion eller hydronio kationformel
Ion eller hydronio kationformel H+ og dens fantastiske evne til å overføre mellom hydrogenbroene til vannmolekylene tillater h3ENTEN+ assosiere i mer komplekse kationformasjoner; slik som Eigens kation, h9ENTEN4+, og Zundels kation, h5ENTEN2+, og mange andre.
Hydroniumionstruktur
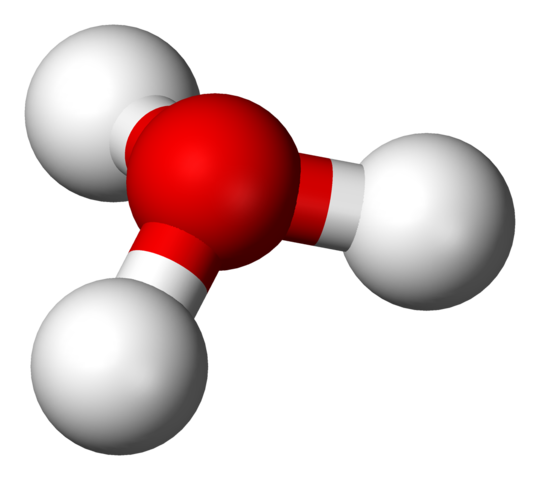 H3O+ -struktur med en sfærer og bar -modell
H3O+ -struktur med en sfærer og bar -modell I det første bildet kunne du se den strukturelle formelen til hydriumionen. Opp nå ser vi dens representasjon med en sfærer og bar -modell. I begge høydepunktene den trigonale pyramidegeometrien, hvis koblingsvinkler (O-H) er 113º; Litt avledet fra 119º for tetrahedronen.
Selv om oksygen har en positiv delvis belastning, betyr ikke dette at det negative området er rundt hydrogenatomer. Tvert imot. Oksygen i h3ENTEN+ Det er enda mer elektronegativt produkt av dets elektroniske mangel; Så all den negative tettheten visualisert på et elektrostatisk potensiell kart:
Kan tjene deg: Kaliumsulfat (K2SO4): Struktur, egenskaper, bruksområder, syntese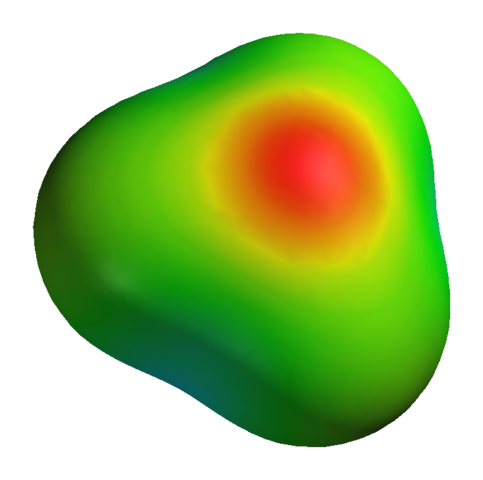 Elektrostatisk potensiell kart for H3O+
Elektrostatisk potensiell kart for H3O+ For ikke å nevne at oksygen har et par frie elektroner, som forsterker enda mer negativ tetthet.
En konsekvens av alt det ovennevnte er at H -hydrogener3ENTEN+ De mister elektronisk tetthet, fordi oksygen tiltrekker det mot seg selv. Derfor h3ENTEN+ Du kan etablere veldig sterke hydrogenkilder med et nærliggende vannmolekyl: H2ENTEN+-H-oh2.
Dette samspillet er nøkkelen bak den fantastiske ioniske mobiliteten til H+ og hvorfor h3ENTEN+ Det er i stand til å assosiere med mange vannmolekyler samtidig.
Surhet
Hydronio ion er en veldig sterk syre. Det er faktisk den sterkeste syren som kan eksistere i vandig løsning. Fordi? Fordi all annen syre sterkere enn ham vil protonere et vannmolekyl for å stamme h3ENTEN+:
Ha + h2O → a- + H3ENTEN+
H3ENTEN+ Det er i stand til å holde seg stabil når det ikke er andre baser i miljøet som er sterkere enn vann. Enhver syre har overholdt dette vil bli klassifisert som en sterk syre. I mellomtiden, hvis syren er svakere enn h3ENTEN+, Da vil ikke en del av HA være fullstendig dissosiert, og vi vil snakke om en svak syre:
Ha + h2Eller ⇌ a- + H3ENTEN+
Derfor, siden h3ENTEN+ Det er den sterkeste syren som eksisterer i vannet, surheten i dette vil avhenge av konsentrasjonen av H3ENTEN+. Dette er grunnlaget for å definere, på enkle termer, surheten i en vandig løsning uttrykt som pH:
pH = -log [h3ENTEN+]
H+ vs. H3ENTEN+
Hydrogenion og hydronium er ikke det samme. H+ Det er mye surere enn h3ENTEN+, Vel, det består av et proton ingenting mer, som vil se etter et molekyl for å få elektroner for all del. Når h+ Få et vannmolekyl danner h3ENTEN+:
Det kan tjene deg: Cupric Oxide (CUO)H+ + H2O → h3ENTEN+
Det er derfor h3ENTEN+ kan bli representert som h+(AC), som indikerer at det er en h+ I vandig medium.
Kraften til en syre måles i dens evne til å donere, i henhold til definisjonen av Brönsted-Lowry, H-ioner+. Hvor mye sterkere det er, jo mer vil det donere+, Nei h3ENTEN+. De sterkeste syrene som noen gang er syntetisert (supercids) er de der H+ Han er "naken"; det vil si uten noe hinder for å hoppe mot molekylet som vil protonere.
Praksisen med å representere h3ENTEN+ som h+(AC) Det er så vanlig at det er mange ganger å snakke om begge deler som om de var de samme, uten at den har påvirket tolkningen av kjemien til løsninger negativt.
Solvasjon
H3ENTEN+ Det kan danne veldig sterke hydrogenbroer med et nærliggende vannmolekyl. Når vi gjør det, har vi kation av Zundel, h5ENTEN2+:
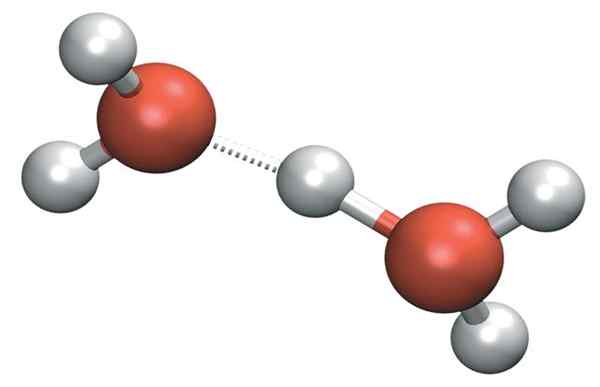 Zundel kation
Zundel kation Men den positive belastningen forblir ikke bare på en enkelt side av kationen: dette kan overføres til det andre vannmolekylet som ion H+:
H2Åh-+Åh2 → H2ENTEN+-H- Å2
Derfor fordeles den positive belastningen mellom begge oksygenatomer for de to vannmolekylene.
I tilfelle av egenkationen, h9ENTEN4+, en h3ENTEN+ danner hydrogenbroer med tre vannmolekyler, og fordeler seg blant dem den positive belastningen takket være et "hopp" h+. Disse hoppene er så raske at de forklarer den store ioniske mobiliteten til H+ I vann, ved hjelp av h3ENTEN+ som et kjøretøy, og vannmolekyler som en motorvei.
H5ENTEN2+ og h9ENTEN4+ De er ikke de eneste kationiske assosiasjonene som H3ENTEN+ kan opprinnelse i vann. Noen molekylære dynamikkberegninger viser eksistensen av en H -klynge3ENTEN+(H2ENTEN)tjue: 20 timers molekyler2Eller samhandle med en H -kation3ENTEN+ og distribuerer blant dem den positive belastningen.
Kan tjene deg: neodym: struktur, egenskaper, brukDerfor h3ENTEN+ og h+ De bygger et nysgjerrig forhold til vannmolekyler, utover surhet.
Du går ut
Akkurat som organiske oksyrom eksisterer, er det intet unntak med oksy avledet fra vannprotonasjon. Dens generelle formel er [h3ENTEN+] [X-], Hvor x- Det er enhver anion som kommer fra oppløsningen av en veldig sterk syre.
Disse saltene får noen ganger navnet på 'monohydratsyrer', siden formelen [h3ENTEN+] [X-] eller h3ENTEN+· X- Det kan også skrives som Hx · H2ENTEN. Dermed kan det være dihydratsyrer, Hx · 2H2Eller, trihydrater, Hx · 3H2Eller osv.
For eksempel kan HCl krystallisere som HCl · H2ÅH3ENTEN+· CL-. Vi har også andre hydroniumsalter som H3ENTEN+· CLO4- eller hclo4· H2Eller, og HBR · 4H2ÅH3ENTEN+· Br-· 3H2ENTEN.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Inorgán kjemiICA. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Hydronium. Hentet fra: i.Wikipedia.org
- Avneet Kahlon & Stephen Lower. (15. august 2020). Hydroniumionet. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Helmestine, Anne Marie, PH.D. (25. august 2020). Hydroniumiondefinisjon. Gjenopprettet fra: Thoughtco.com
- Redaktørene av Enyclopaedia Britannica. (2020). Hydrogenion. Gjenopprettet fra: Britannica.com

