Kjemisk treghet

- 2250
- 220
- Magnus Sander Berntsen
Hva er kjemisk treghet?
Kjemisk treghet er eiendommen som har et stoff eller materiale for å motstå nedbrytningen forårsaket av eksterne midler. I denne forstand er dets fysiske egenskaper og, spesielt kjemikalier, forblir uendret. Det er ingen koblingspauser eller dannelse av nye.
Nå er kjemisk treghet relativt. Noen stoffer eller materialer er mer inerte enn andre, noe som skyldes arten og styrken i deres interaksjoner. Som i prinsippet, kontrast fenomenene for endring, uunnværlig for at materie skal utvikle seg i forskjellige produkter.
 Et gullkikk. Gull er korrosjon mer motstandsdyktig metall
Et gullkikk. Gull er korrosjon mer motstandsdyktig metall Det er grunnen til at det er inert at det er et stoff eller materiale, det vil alltid være en tilstand som det blir reaktivt. For eksempel er gull det edleste av metaller, og regnes som inert. Imidlertid blir det angrepet og oppløst av kongelig vann, en løsning som den er veldig reaktiv.
Kanskje og til dags dato er det eneste kjemiske elementet som har vist en absolutt kjemisk treghet neon. Ingen forbindelse er kjent, ikke engang under ultrapressure -forhold, for eksempel de i kjernene til planetene eller månene.
Kjennetegn ved kjemisk treghet
Mangel på oksidasjon
For at et materiale eller et stoff skal være inert, i prinsippet, skal det ikke reagere med den omkringliggende luften. Dette betyr at det ikke har en tendens til å danne koblinger med oksygen- eller nitrogenmolekyler som omgir overflaten. Med andre ord: ikke oksider lufteksponeringen.
Mat og alle det aktuelle organiske stoffer har en tendens til å oksidere. Det sies derfor at de ikke er inerte.
Mangel på oksidasjon i kjemisk treghet bør opprettholdes ved temperaturer høyere enn 100 ºC. Jo høyere temperatur, stoffene eller materialene vil begynne å oksidere raskere, og reagerer med henholdsvis oksygen eller nitrogen i luften for å danne oksider eller nituros.
Syremotstand eller alkalier
En annen funksjon som er til stede i kjemisk treghet er motstanden mot syrer eller baser. Dette betyr at et inert stoff eller materiale skal motstå angrepet av syrer, uten en tendens til å fornedre ved aksept av H -ioner+ eller veldig sterke elektrofiler; eller angrepet av basene, uten å nedbryte på grunn av OH -ionene-.
Det kan tjene deg: perbromsyre (HBRO4): Egenskaper, risikoer og bruksområderIgjen, dette er relativt, siden det er forskjellige typer syrer og baser. Noen inerte stoffer kan være veldig motstandsdyktige mot, for eksempel svovelsyre, men de blir degradert i stedet for den nedre dråpen av fluorhoridsyre. Slik er tilfellet med glassflasker når de reagerer med HF.
Elektronisk stabilitet
Ovennevnte egenskaper har å gjøre med den termodynamiske stabiliteten avledet fra arten av intermolekylære interaksjoner, i tillegg til andre faktorer. På den annen side skimtes også kjemisk treghet i de elektroniske egenskapene til de samme atomene.
Jo mer stabil den elektroniske konfigurasjonen av et atom, jo lavere er det tendens til å vinne eller miste elektroner. Derfor vil det utvise større kjemisk treghet. Dette er tilfelle av edle gasser, som vil bli sett i neste avsnitt.
Bioinaktivitet
I medisin er et stoff eller materiale inert hvis det mangler bioaktivitet. Det vil si at den kan være lokalisert i en organisme uten å bli assimilert under metabolismen. Denne funksjonen er veldig ønskelig i beinproteser, eller i vevsrekonstruksjon.
Strålingsmotstand
Til slutt skal inerte stoffer eller materialer også være motstandsdyktig mot stråling, være ultrafiolett eller kjernefysisk.
Eksempler på kjemisk treghet
Glass
 Glass er et relativt inert materiale
Glass er et relativt inert materiale Blant eksemplene på materialer som viser kjemisk treghet, har vi glasset. Hvis de ikke var inerte, ville de ikke tjene til utdyping av containere eller containere, da de ville reagert med innholdet. Avhengig av sammensetningen, for eksempel borosilikater, kan de bli veldig motstandsdyktige mot korrosjon og temperatur.
Som nevnt i begynnelsen, er glass imidlertid ikke immun mot alle stoffer: det reagerer med HF, til og med fortynnet, varme alkalier, som NaOH og H3Po4 Veldig konsentrert og varmt.
Kan tjene deg: pyrolysePlast
 Hvis teflons panne ikke var inert, ville den ødelegge alle matvarene vi kokte i den. Kilde: Mdevicente, CC0, via Wikimedia Commons
Hvis teflons panne ikke var inert, ville den ødelegge alle matvarene vi kokte i den. Kilde: Mdevicente, CC0, via Wikimedia Commons Plast oppfyller også funksjoner som ligner på glass, men det er mange flere allsidige (de bryter ikke så lett). Noen plast, som teflon (polytetrafluoroetylen), kynar (polyvinylidenfluorid) og telen (polydikcyklopentadien), er ekstremt motstandsdyktige mot angrepet av syrer og korrosjon.
Keramikk
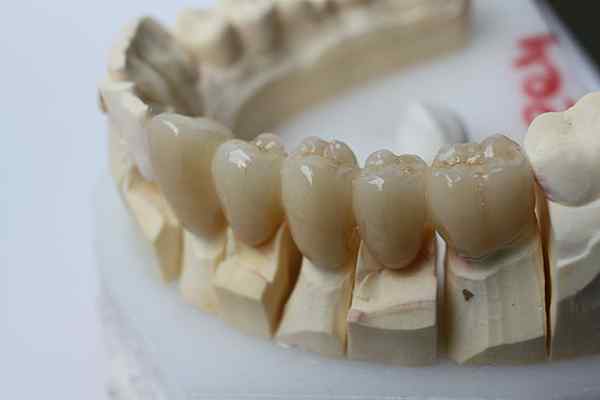 Den kjemiske tregheten til zirkoniet gjør det mulig å brukes til tannproteser. Kilde: Bin Im Garten via Wikipedia.
Den kjemiske tregheten til zirkoniet gjør det mulig å brukes til tannproteser. Kilde: Bin Im Garten via Wikipedia. Den inerte keramikken går et skritt lenger enn plast. De er beregnet på applikasjoner der høye temperaturer dominerer, ganske vanlig i bil- og romfartsindustrien; eller i biokjemiske systemer, som i legemiddelindustrien og i implementeringen av beinproteser.
Blant noen av disse keramikkene med flott kjemisk treghet vi har: aluminiumoksyd (til2ENTEN3, Til stede i Corindon og Sapphire), silikatene (spesialisert glass), silisiumkarbid (sic, hard og iherdig) og zirconia (Zio2).
Inerte gasser
Forlater de inerte materialene til side, vi har nå inerte stoffer. Inerte gasser er ikke veldig reaktive, så deres tilstedeværelse i luften innebærer ingen risiko for reaksjon under normale forhold.
Blant disse gassene har vi CO2, Co og n2. Nitrogen er det mest inerte av alle disse gassene; Og likevel er han i stand til å reagere varmt med noen metaller for å danne nituros, m3Nn, å være n Valencia eller metalloksidasjonstilstand.
Co2 Den er relativt inert; Bortsett fra når det oppfyller alkaliske løsninger, der det blir omdannet til karbonater, eller i nærvær av kullanhydraiske enzymer.
For sin del forblir CO inert ved romtemperatur; Men ved høye temperaturer reagerer den med kull, vanndamp, metalloksider, olefiner, blant andre forbindelser.
Kan tjene deg: Kjemisk balanse: Forklaring, faktorer, typer, eksemplerSlike reaksjoner kan fortsette i nærvær av metallkatalysatorer. På samme måte er CO, selv uten å bryte sine kovalente bindinger, i stand til å koordinere nøytrale metallatomer.
Noble metaller
Noble metaller er de mest motstandsdyktige mot korrosjon og angrep av syrer og alkalier. Hver, ved høye temperaturer, eller i støvformat, vil reagere med oksygen eller fluor. Derfor er den kjemiske tregheten til disse elementene ganske relativt.
Blant de edle metaller vi har: Gold (AU), Ruthenio (Ru), Platinum (PT), Paladio (PD), Osmio (OS) og Iridido (IR). Av dem er gull det edleste, og er til og med i en metallisk tilstand i jordskorpen.
Edle gasser
Og til slutt, i det høyeste setet for kjemisk treghet, har vi edle gasser: helium (He), Neon (NE), Argon (AR), Crypton (KR), Xenon (XE) og Radon (RN). Alle av dem er ekstremt inerte. Imidlertid har mange forbindelser av xenon blitt syntetisert, inkludert salter kjent som Perxenatos, med XEO -anionen64-.
 Neonlys tilsvarer de mest inerte kjemiske elementene i naturen
Neonlys tilsvarer de mest inerte kjemiske elementene i naturen Dens kjemiske treghet skyldes at atomene deres inneholder deres energi og orbitale lag helt fulle av elektroner. Fra argonen er det mulig at de under ultrapresjoner vil få tilgang til elektroner ved å bruke tomme orbital eller flere energisjikt (for eksempel 3D og 4S); ting som er umulig for helium eller neon.
Av edle gasser nøyaktig helium og neon er de mest inerte. Helium er i stand til å danne forbindelser med natrium til veldig høyt trykk (Hena).
I mellomtiden er ingen forbindelse kjent i det hele tatt, å være enda mer inert enn helium selv på grunn av hans større effektive kjernefysiske belastning, som sterkt frastøter ethvert atom som prøver å nærme seg neonatomer.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Shiver & Atkins. (2008). Inorgán kjemiICA. (Fjerde utgave). Mc Graw Hill.
- Wikipedia. (2020). Kjemisk inert. Hentet fra: i.Wikipedia.org
- Dr. Doug Stewart. (2020). Definisjon av inert. Gjenopprettet fra: Chemicool.com
- Elsevier f.V. (2020). Kjemisk inerthet. Scientedirect. Hentet fra: Scientedirect.com
- Clara Moskowitz. (20. mars 2018). En edelgassoverraskelse: Helium kan danne rare forbindelser. Gjenopprettet fra: Scientific American.com
- Coorstek. (2020). Kjemiske egenskaper ved teknisk keramikk. Gjenopprettet fra: Coorstek.com
- Osborne Industries. (2020). De 3 suresistente plastene. Gjenopprettet fra: Osborneindustries.com

