Lov om ideelle gasser formel og enheter, applikasjoner, eksempler

- 849
- 27
- Jonathan Moe
De Ideell gasslov Det er en statlig ligning som beskriver en sammenheng mellom tilstandsfunksjonene assosiert med den ideelle gassen; som temperatur, trykk, volum og føflekker. Denne loven gjør det mulig å studere ekte gassformede systemer som sammenligner dem med sine idealiserte versjoner.
En ideell gass er en teoretisk gass, sammensatt av spesifikke eller sfæriske partikler som beveger seg tilfeldig; Med stor kinetisk energi, der det eneste samspillet mellom dem er helt elastiske sammenstøt. I tillegg overholder de den ideelle gassloven.
 Den ideelle gassloven tillater studie og forståelse av mange virkelige gassformede systemer. Kilde: Pxhere.
Den ideelle gassloven tillater studie og forståelse av mange virkelige gassformede systemer. Kilde: Pxhere. Ved standard trykk og temperatur (STP): 1 atm av trykk, og en temperatur på 0 ºC, oppfører de fleste ekte gasser seg kvalitativt som ideelle gasser; forutsatt at tettheten deres er lave. Store intermolekylære eller interatomiske avstander (for edelgasser) letter slike tilnærminger.
Under STP -forhold oksygen, nitrogen, hydrogen, edle gasser og noen sammensatte gasser, for eksempel karbondioksid, oppfører seg som en ideell gass.
Den ideelle gassmodellen har en tendens til å mislykkes ved lave temperaturer, høye trykk og høye partikler; Når intermolekylære interaksjoner, så vel som størrelsen på partiklene, blir viktig.
Ideal Gases Law er en sammensetning av tre gaselover: The Law of Boyle og Mariotte, The Law of Charles og Gay-Lussac, og Avogadros lov.
[TOC]
Formel og enheter

Gasseloven uttrykkes matematisk med formelen:
PV = NRT
Der P er trykket som utøves av en gass. Det kommer vanligvis til uttrykk med atmosfæreenheten (ATM), selv om den kan uttrykkes i andre enheter: MMHG, Pascal, Bar, etc.
Volum V okkupert av gass uttrykkes vanligvis med enhetens enhet (L). Samtidig som n Det er antall føflekker, r den universelle konstanten av gasser, og t temperaturen uttrykt i Kelvin (k).
Det mest brukte uttrykket i R -gasser tilsvarer 0,08206 l · atm · k-1· Mol-1. Selv om enheten for gasskonstanten har en verdi på 8 3145 J · mol-1· K-1. Begge er gyldige så lenge de er forsiktige med enhetene til de andre variablene (P, T og V).
Ideal Gases Law er en kombinasjon av Boyle-Maleotte's Law, Charles-Gay-Lussacs lov og Avogadros lov.
Boyle-Maleotte Law
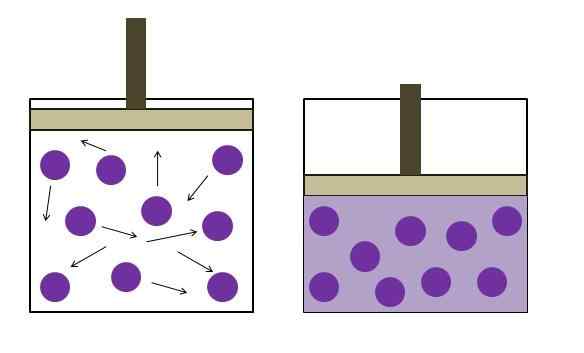 Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar
Økt trykkreduksjonstrykk. Kilde: Gabriel Bolívar Det ble formulert uavhengig av fysikeren Robert Boyle (1662) og den fysiske og botanikeren Edme Mariotte (1676). Loven er oppgitt som følger: Ved en konstant temperatur er volumet av en fast masse av en gass omvendt proporsjonal med trykket den utøver.
Kan tjene deg: terpenosPV ∝ K
Ved å bruke to punkter:
P1V1 = S2V2
Charles-Gay-Lussac Law
 Kinesiske lykter eller ønsker. Kilde: Pxhere.
Kinesiske lykter eller ønsker. Kilde: Pxhere. Loven ble publisert av Gay-Lussac i 1803, men henvist til verket som ikke er utgitt av Jacques Charles (1787). Av denne grunn er loven kjent som Charles lov.
Loven fastslår at det ved konstant trykk er et direkte forhold mellom proporsjonaliteten mellom volumet okkupert av en gass og dens temperatur.
V ∝ k2T
Ved å bruke to punkter:
V1/T1 = V2/T2
V1T2 = V2T1
Avogadro Law
Loven ble uttalt av Amadeo Avogadro i 1811, og bemerket at like volum av alle gasser, med samme trykk og temperatur, har samme antall molekyler.
V1/n1 = V2/n2
Hva som etablerer den ideelle gassloven?
Gjennom den ideelle gassloven er det etablert et forhold mellom fire uavhengige fysiske egenskaper for gass: trykket, volumet, temperaturen og mengden av gass. Det er nok å vite verdien av tre av dem, for å få den av de resterende.
Loven etablerer forholdene som indikerer når en gass oppfører seg ideelt, og når den beveger seg bort fra denne oppførselen.
For eksempel har den så -kalt komprimeringsfaktoren (PV/NRT) en verdi på 1 for ideelle gasser. En verdi av verdien av 1 for kompresjonsfaktoren, indikerer at gassatferd beveger seg bort fra den ideelle gassen.
Derfor vil det bli gjort en feil når du bruker den ideelle gassen til en gass som ikke oppfører seg i henhold til modellen.
applikasjoner
Beregning av tetthet og molmasse av en gass
Ligningen av den ideelle gassloven kan brukes i beregningen av tettheten av en gass og dens molmasse. Når du gjør en enkel modifisering, kan du finne et matematisk uttrykk som relaterer tettheten (D) til en gass og dens molmasse (M):
D = MP/RT
Og rydding m:
M = DRT/P
Beregning av volumet av en gass produsert i en kjemisk reaksjon
Støkiometri er grenen av kjemi som relaterer mengden av hvert av reagensene som har produktene som er involvert i en kjemisk reaksjon, vanligvis uttrykt i mol.
Bruken av de ideelle gassene ligning tillater bestemmelse av volumet av en gass produsert i en kjemisk reaksjon; Siden, fra den kjemiske reaksjonen, kan du få antall føflekker. Deretter kan volumet på gassen beregnes:
Kan tjene deg: glassionomer: forberedelse, egenskaper, typer, bruksområderPV = NRT
V = nrt/p
Måling V kan bestemme ytelsen eller fremgangen til nevnte reaksjon. Når det ikke er flere gasser, er det veiledende at reagenser har helt utmattet.
Beregning av delvis trykk av gassene som er til stede i en blanding
Den ideelle gassloven kan brukes, sammen med Daltons delvise presselov, for å beregne delvis presset til de forskjellige gassene som er til stede i en gassblanding.
Forholdet brukes:
P = nrt/v
For å finne trykket fra hver av gassene som er til stede i blandingen.
Volum av gass samlet i vann
Det blir gjort reaksjon som produserer en gass, som samles inn ved en eksperimentell design i vann. Totalt gasstrykk er kjent pluss vanndamptrykk. Verdien av sistnevnte kan oppnås i en tabell, og ved subtraksjon kan gasstrykket beregnes.
Fra støkiometrien til den kjemiske reaksjonen kan antall mol av gassen oppnås og anvende forholdet:
V = nrt/p
Volumet av gassen som produseres beregnes.
Eksempler på beregninger
Oppgave 1
En gass har en tetthet på 0,0847 g/l til 17 ºC, og et trykk på 760 torr. Hva er din molmasse? Hva er gassen?
Vi starter fra ligningen
M = DRT/P
Vi konverterer først temperaturenhetene til Kelvin:
T = 17 ºC + 273,15 K = 290,15 K
Og trykket på 760 torr tilsvarer det på 1 atm. Nå trenger du bare å erstatte verdiene og løse:
M = (0,0847 g/l) (0,08206 l · atm · k-1· Mol-1) (290,15 k) / 1 atm
M = 2.016 g/mol
Denne molmassen kan tilsvare en enkelt art: det diatomiske hydrogenmolekylet, h2.
Oppgave 2
En masse på 0,00553 g kvikksølv (Hg) i en gassfase, er i et volum på 520 l, og ved en temperatur på 507 K. Beregn trykket utøvd av HG. Molmassen til Hg er 200,59 g/mol.
Problemet løses ved å bruke ligningen:
PV = NRT
Informasjon om antall mol HG vises ikke; Men de kan fås ved å bruke sin molmasse:
Mol Hg = (0,00553 g Hg) (1 mol Hg/200,59 g)
Kan tjene deg: oksygen: egenskaper, struktur, risiko, bruk= 2 757 · 10-5 Føflekker
Nå må vi bare tømme P og erstatte verdiene:
P = nrt/v
= (2 757 · 10-5 føflekker) (8 206 · 10-2 L · atm · k-1· Mol-1) (507 k)/ 520 l
= 2,2 · 10-6 ATM
Øvelse 3
Beregn trykket generert av saltsyre produsert ved å reagere 4,8 g klorgass (CL2) med hydrogengass (h2), I et volum på 5,25 l, og ved en temperatur på 310 K. Molmassen til CL2 er 70,9 g/mol.
H2 g) + Cl2 g) → 2 HCl(g)
Problemet løses ved å bruke den ideelle gassens ligning. Men mengden HCl er uttrykt i gram og ikke i føflekker, så den rette transformasjonen blir gjort.
Mol hcl = (4,8 g cl2) (1 mol CL2/70,9 g Cl2) (2 mol HCl/1 mol CL2)
= 0.135 mol HCl
Bruke ligningen for den ideelle gassloven:
PV = NRT
P = nrt/v
= (0,135 mol HCl) (0,08206 l · atm · k-1· Mol-1) (310 k) / 5,25 l
= 0,65 atm
Oppgave 4
En prøve på 0,130 g av en gassform. Hva er din molmasse?
For å bruke den ideelle gassligningen, må flere endringer først gjøre:
V = (140 ml) (1 l/1000 ml)
= 0,14 l
Når du har volumet i liter, må du nå uttrykke temperaturen i Kelvin:
T = 70 ºC + 273,15 K = 243,15 K
Og til slutt må vi gjøre press til atmosfæreenheter:
P = (720 torr) (1 atm/760 torr)
= 0,947 atm
Det første trinnet i å løse problemet er å få antall føflekker fra forbindelsen. For dette brukes ligningen for de ideelle gassene og vi ryddet n:
PV = NRT
N = PV / RT
= (0,947 atm) (0,14 L) / (0,08206 L · atm · K-1· Mol-1) (243.15 K)
= 0,067 føflekker
Det er bare nødvendig å beregne den molære deigen ved å dele gramene mellom de oppnådde føflekkene:
Molmasse = gram av forbindelsen / antall føflekker.
= 0,130 g / 0,067 føflekker
= 19,49 g/mol
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Iran. Levine. (2014). Prinsipper for fysikjemi. Sjette utgave. Mc Graw Hill.
- Glasstone. (1970). Fysisk kjemisk traktat. Andre utgave. Aguilar.
- Mathews, c. K., Van Holde, K. OG., Og Ahern, K. G. (2002). Biokjemi. 3var Utgave. Pearson Addison Wesley redaksjon.
- Wikipedia. (2019). Ideell gass. Hentet fra: i.Wikipedia.org
- Redaksjon. (2018). Boyle Law eller Boyle-Maleotte Law | Gasslover. Gjenopprettet fra: iquimicas.com
- Jessie a. Nøkkel. (s.F.). Den ideelle gassloven og underapplikasjonene. Hentet fra: OpenTextBc.Ac

