Raault prinsipp og formellov, eksempler, øvelser
- 2962
- 522
- Jonathan Carlsen
De Rauolts lov Det er en som brukes til å forklare nedstigningen eller reduksjonen av damptrykk, til stede på en løsning, på grunn av oppløsningen av et ikke -flyktig oppløst stoff, for eksempel et salt eller en organisk forbindelse.
Denne loven brukes også til å analysere og beskrive sammensetningen av flyktige løsningsmidler i gassfasen, lokalisert i rommet på en løsning som presenterer en blanding av dem. Loven bærer navnet hans til ære for sin skaper, François-Marie Rauolt (1830-1901).
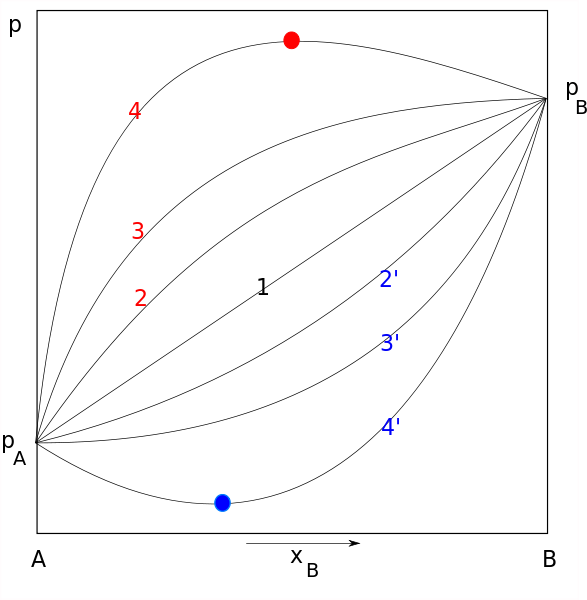
 Raaults lovdiagrammer. Linje 1 representerer den ideelle oppførselen, mens rød og blå tilsvarer henholdsvis positive og negative avvik. Kilde: Joanna Kośmider / Public Domain
Raaults lovdiagrammer. Linje 1 representerer den ideelle oppførselen, mens rød og blå tilsvarer henholdsvis positive og negative avvik. Kilde: Joanna Kośmider / Public Domain Rauolts lov gjelder ideelle løsninger som er i samsvar med noen egenskaper, inkludert følgende: intermolekylære krefter mellom like molekyler (sammenhengende krefter) må være lik intermolekylære krefter mellom forskjellige eller forskjellige molekyler (limkrefter).
Mange av løsningene er ikke ideelle, noe som forklarer avvikene i Rauolts lov observert i noen blandinger av flyktige løsemidler. For eksempel kloroformblandingen (CH3Cl) og aceton (velg3Coch3), presenterer et negativt avvik fra Raouls lov.
 François-Marie Raault
François-Marie Raault Damptrykket i gassfasen i slike tilfeller er mindre enn den forutsagt av loven, som kan forklares ved dannelse av hydrogenbroer mellom komponentene i blandingen.
[TOC]
Prinsipp og formel
Rauolts lov indikerer at det delvise damptrykket som utøves av en flyktig komponent eller løsningsmiddel av gassblandingen, over løsningen, er relatert til damptrykket som utøves av den rene flyktige komponenten eller løsningsmidlet, og deres respektive molære fraksjoner.
Kan tjene deg: nepelometriFølgende ligning oppsummerer ovennevnte:
PSv = SSvº · xSv
Hvor pSv Det er det delvise trykket til det flyktige løsningsmidlet i brusblandingen, PSvº trykket til det rene flyktige løsemiddelet, og xSv den molære fraksjonen i løsningen av det flyktige løsningsmidlet.
Blanding av flyktige løsningsmidler
Hvis du har en blanding av to flyktige løsningsmidler (A og B) i løsningen, kan du beregne damptrykket som de stammer fra gassfasen, over løsningen. Dette vil være en sum av delvis trykk som utøves av gasser A og B:
PTIL = XTIL · PTILº
PB = XB · PBº
Så å legge til trykket til A og B får vi det totale P -trykket:
P = xTIL · PTILº +xB · PBº
Hvor P er damptrykket til brusblandingen på toppen av løsningen, xTIL og xB de molære fraksjonene av de flyktige løsningsmidlene A og B i blandingen, og PTILº og pBº damptrykkene til de rene flyktige løsningsmidlene A og B.
Redusert trykk i gassfasen på grunn av tilstedeværelsen av et ikke -flyktig oppløst stoff
Det delvise trykket til et flyktig løsningsmiddel i gassfasen er gitt av uttrykket:
P = pTILº · xTIL
I nærvær av en løst B i løsningen uttrykkes den molære fraksjonen av B som følger:
XB = 1 -xTIL
Da, gjennom enkel matematisk behandling, nås uttrykket:
ΔP = pTILº · xB (1)
Der ΔP er reduksjonen i delvis trykket til løsningsmidlet i gassfasen.
Det matematiske uttrykket (1) indikerer reduksjonen i damptrykket til et løsningsmiddel på grunn av tilstedeværelsen av et ikke -flyktig B -løs. Nedgangen i løsningsmiddeldamptrykk er blitt forklart på grunn av plasseringen av oppløst B -molekyler på løsningsoverflaten.
Det kan tjene deg: karbonylgruppe: egenskaper, egenskaper, nomenklatur, reaktivitetTilstedeværelsen av løst B -molekyler ville gi en reduksjon i konsentrasjonen av løsningsmiddel A -molekyler på overflaten av løsningen og begrense dens fordampning; Og dermed forklare, reduksjonen i damptrykk i gassfasen.
Eksempler
Raaults lov tjener til å beregne damptrykket til en flyktig komponent i en løsning, for eksempel etanol, benzen, toluen, etan, propan, etc., i verdensrommet på løsningen.
Det kan brukes til å beregne damptrykket som genereres i rommet på en løsning, som en konsekvens av blandingen av flyktige væsker, enten benzen og toluen, etan og propan, aceton og etanol, etc.
Med denne loven kan du også bestemme hva.
Løste øvelser
Oppgave 1
Beregn damptrykket til en tilberedt løsning ved å løse opp 60 g natriumklorid (NaCl) i 400 g vann (h2ENTEN). Vanndamptrykk (sH2Oº) En 37 ºC er 47,1 mmhg. Molekylvekt h2O = 18 g/mol og molekylvekt NaCl = 58,5 g/mol.
Vi beregner først molene med vann og natriumklorid for å bestemme deres molære fraksjoner:
Mol av h2O = gram av h2O / pm h2ENTEN
= 400 g / (18 g / mol)
= 22.22 føflekker
Mol naCl = g naCl / pm naCl
= 60 g / (58,5 g / mol)
= 1,03 føflekker
NaCl er en elektrolytisk forbindelse som dissosierer i NA+ + Cl-. Derfor dissosierer 1,03 mol NaCl i 1,03 mol NA+ og 1.03 mol CL-.
Det kan tjene deg: Maillard -reaksjonVi har uttrykket:
Pv = XH2O · PH2Oº
Vi mangler derfor den molære fraksjonen av vann:
XH2O = Mol av h2O / (mol av h2O +mol av na+ + Mol cl-)
= 22.2 Mol / 22.22 Mol +1.03 Mol +1.03 Mol
= 0.896
Og vi beregner Pv:
Pv = 47,1 mmHg · 0.896
Pv = 42,20 mmHg
Å være reduksjonen i damptrykk på grunn av tilstedeværelsen av natriumklorid:
ΔPv = 47,1 mmHg - 42,20 mmhg
= 4,9 mmHg
Oppgave 2
Ved en temperatur på -100 ºC etan (velg3Ch3) og propan (Cho3Ch2Ch3) De er væsker. Ved den temperaturen, damptrykket til ren etan (PEtanoº) er 394 mmHg, mens damptrykket til ren propan (Ppropanº) er 22 mmhg. Det som vil være damptrykket på en løsning som inneholder ekvimolare mengder av begge forbindelser?
Problemtilnærmingen indikerer at løsningen inneholder ekvimolare mengder av forbindelsene. Dette innebærer at den molære fraksjonen av forbindelsen og propanforbindelsene nødvendigvis er lik 0,5.
Igjen kommer løsningen av uttrykket:
Pv = SEtano + Ppropan
Vi beregner delvis trykk fra både etan og propan:
PEtano = SEtanoº · xEtano
= 394 mmHg · 0,5
= 197 mmHg
Ppropan = Spropanº · xpropan
= 22 mmHg · 0,5
= 11 mmHg
Og så beregner vi endelig Pv:
Pv = SEtano + Ppropan
= 197 mmHg +11 mmhg
= 208 mmHg
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning
- Wikipedia. (2020). Raults lov. Hentet fra: i.Wikipedia.org
- Helmestine, Anne Marie, PH.D. (11. februar 2020). Raults lovdefinisjon i kjemi. Gjenopprettet fra: Thoughtco.com
- Encyclopædia Britannica. (2020). Raults lov. Gjenopprettet fra: Britannica.com
- Clark J., Ly i., & Khan s. (18. mai 2020). Raults lov. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- « Vinkelmomentmengde, bevaring, eksempler, øvelser
- Ugjennomsiktige objekter konsept, egenskaper og eksempler »

