Alkalineter metaller
- 2669
- 134
- Dr. Andreas Hopland
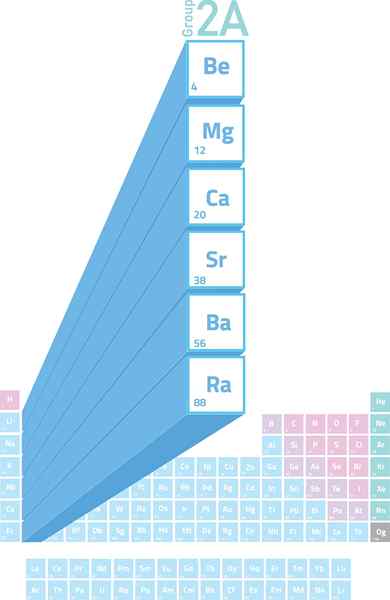
 Plassering av alkalinotrous metaller i det periodiske bordet
Plassering av alkalinotrous metaller i det periodiske bordet Hva er alkalinelt metaller?
De Alkalineter metaller De er elementene i gruppe 2 (tidligere kalt gruppe 2A) i det periodiske tabellen. Det vil si at de er dannet av de 6 elementene i den andre kolonnen i den periodiske tabellen, alt fra beryllium (BE) til radioen (RA).
De er en gruppe av ganske reaktive og relativt vanlige metallelementer. De har bare to valenselektroner lokalisert i en orbital s. Av denne grunn tilhører de blokkering av det periodiske bordet.
Navnet "Alkalinoterreo" kommer fra foreningen av "alkaliske" ord, som er en annen måte å si grunnleggende, og jorden, som er slik de ble fortalt før oksider. Så alkalinotrous metaller betyr bokstavelig talt metaller som danner grunnleggende oksider.
Disse metallene har mange applikasjoner som gjør dem viktige i vårt nåværende samfunn, spesielt magnesium. Disse applikasjonene skyldes deres spesielle egenskaper, som er beskrevet nedenfor.
Egenskaper til alkalinders metaller
De har metallutseende
Alle alkalinotrous metaller har sølvfarge med metallisk lysstyrke. Radonen er også radioaktiv, slik at den skinner i mørket og avgir et karakteristisk grønt lys.
De er små tette metaller
Alle alkalinotrous metaller er tettere enn vann, men er mindre tette enn de fleste andre metallelementer i det periodiske bordet.
Tettheten i denne gruppen varierer fra 1,54 g/cm3 For kalsium opp til 5,5 g/cm3 For radioen, som er betydelig mindre enn tettheten til andre metaller som jern (7,9 g/cm3), kobber (9,0 g/cm3), bly (11,3 g/cm3) og El Mercurio (13,5 g/cm3), for å nevne noen.
De har relativt lave smelte- og kokepunkter
Å være metaller, er smelte- og kokepunktene større enn for de fleste ikke -metaller. Imidlertid er de lavere enn fusjons- og kokepunktene for de fleste andre metaller, med noen unntak.
Kan tjene deg: Arrhenius ligningDe har Valencia +2
På grunn av deres elektroniske konfigurasjon, har disse metallene en tendens til å miste to elektroner når de reagerer med andre elementer som ikke -metaller. Av denne grunn er hans eneste Valencia +2.
De er relativt reaktive
ALKALINOTERROUS METALER er mye mer reaktive enn metaller som jern eller kobber, men er mindre reaktive enn alkaliske metaller (elementene i gruppe 1). Jo lavere gruppe, jo mer reaktiv er metallet.
For eksempel reagerer ikke beryllium (den første av gruppen) med vann, mens de følgende to kan reagere med varmt vann og de siste kan til og med reagere med kaldt vann.
Reagere med luft for å danne grunnleggende oksider
Disse metallene har en tendens til å danne grunnleggende oksider når de reagerer med luftoksygen. Dette er faktisk grunnen til at de kalles alkaliner. Disse oksydene, når de oppløses i vann, blir hydroksider som produserer alkaliske eller grunnleggende løsninger.
Alkalinotrous metallapplikasjoner
I teknologibransjen
Noen av de alkalinotiske metaller brukes i halvlederproduksjon. Disse er viktige i konstruksjonen av elektroniske kretsløp som de som inneholder praktisk talt alle moderne elektriske apparater, fra datamaskiner og mobiltelefoner, til vaskemaskiner, biler og andre.
I matindustrien
Kalsium er et essensielt næringsstoff for livet. Det er en del av strukturen i beinene og har andre viktige funksjoner i kroppen. Av denne grunn blir dette elementet lagt til som en formidler til mange mat fra korn til meieriprodukter. I tillegg brukes den også i ostproduksjon.
Det kan tjene deg: sirkonium: historie, egenskaper, struktur, risiko, brukI bilindustrien
Noen av de alkalinotiske metaller har veldig gode mekaniske egenskaper, noe som betyr at de er harde og motstandsdyktige. I tillegg er de korrosjonsbestandige, så de brukes ofte i produksjon av luksushjul for biler, så vel som andre deler av dem.
I militærindustrien
På grunn av deres mekaniske egenskaper og lav tetthet, brukes metaller som magnesium og beryllium i konstruksjonen av kampfly, satellitter og helikoptre.
I tillegg, på grunn av deres elektriske egenskaper, brukes de også i fremstilling av forskjellige typer sensorer og optiske og elektroniske systemer som militærindustrien bruker for å lage våpen og kommunikasjonssystemer.
De seks alkaliske metaller
Det er bare seks alkaliske metaller. Deretter er det en kort beskrivelse av hver av dem:
Beryllium (være)
Det er element nummer 4 i den periodiske tabellen og den første av gruppen av alkalinders metaller. Det er et veldig lett, sterkt metall med unike egenskaper som gjør det nyttig i fremstilling av halvledere.
Magnesium (Mg)
Magnesium er et relativt lett sølvmetall, med et lavt smelte- og kokepunkt (sammenlignet med andre metaller). Det er veldig hardt og motstandsdyktig og brukes ofte i fremstilling av bildeler og som tilsetningsstoff i tilberedningen av legeringer som visse typer stål.
Det er det andre alkalinske metall og element nummer 12 i det periodiske bordet. Som andre elementer i denne gruppen, er det et essensielt næringsstoff for livet.
Kalsium (CA)
Kalsium er det 5. mest tallrike elementet i jordens cortex. Det finnes som kalsiumkarbonat i mange mineraler og bergarter og er også et essensielt element for livet på grunn av dets deltakelse i dannelsen av bein og dets betydning i nervesystemet.
Kan tjene deg: strontiumklorid (SRCL2)Dette metallet er element nummer 20 i det periodiske tabellen, er i fjerde periode og er det tredje alkalinske metall.
Strontium (SR)
Element nummer 38 og fjerde alkalisk metall er strontium. Det er tyngre enn kalsium, men det virker mye når det gjelder kjemiske og fysiske egenskaper. Faktisk kan strontium erstatte kalsium i bein.
Dette er spesielt problematisk når vi utsetter oss for radioaktiv strontium som oppstår etter en kjernefysisk reaksjon, siden det, når vi holder oss til beinene, er veldig vanskelig å eliminere fra kroppen og forgifter oss med stråling litt etter litt.
Barium (BA)
Dette elementet har atomnummer 56 og har også egenskaper ganske likt de for kalsium og strontium. Det er et ganske mykt og veldig reaktivt metall som ikke er elementært. Det er en av de alkalinoters metaller med større metallisk karakter.
Radio (RA)
Det siste elementet i Alcalinoterreos -gruppen er radioen, et radioaktivt metall (derav navnet) som avgir et svakt grønt lys som er lett å observere i mørket.
Det pleide å bli brukt mye til utarbeidelse av malerier som skinner i mørket, men etter at faren for helse er oppdaget, var bruken forbudt.

