Myoglobin

- 3758
- 1055
- Magnus Sander Berntsen
 Myoglobinstruktur
Myoglobinstruktur Hva er myoglobin?
De Myoglobin Det er et intracellulært kuleprotein som finnes i cytosol av skjelett- og hjertemuskelceller. Den grunnleggende funksjonen er å utgjøre en oksygenreserve og favorisere intracellulær oksygentransport.
John Kendrew og Max Perutz mottok Nobelprisen i kjemi i 1962 for sine studier på kuleproteiner. Disse forfatterne belyser henholdsvis den tre -dimensjonale strukturen til henholdsvis myoglobin og hemoglobin. Historisk sett var myoglobin et av de første proteinene som den tre -dimensjonale strukturen ble bestemt.
Globulære proteiner er kompakte molekyler med en sfærisk form; De er oppløselige i cytosol eller i lipiddelen av cellemembraner. De er ansvarlige for de viktigste biologiske handlingene, i motsetning til fibrøse proteiner, hvis hovedfunksjoner er strukturelle.
Myoglobin gir ferskt kjøtt rødt. Dette skjer når myoglobin er oksygenert som oksimioglobin og jernet som komponerer det er i jernholdig jern: MB-Fe2+O2.
Når kjøttet blir utsatt for miljøet, endres jernholdig, ustabilt, oksidert og blir jern og under disse forholdene endres fargen til brune toner for metamioglobindannelse (MB-Fe3 + + O2 ●-).
Normalt er nivåene av blodblobin veldig små, de er i størrelsesorden mikrogram per liter (μg/l). Disse nivåene øker når muskelødeleggelse skjer som ved rabdomyolyse av skjelettmuskulatur eller i tilfelle hjerteinfarkt med ødeleggelse av vev og i noen myopatier.
Dens tilstedeværelse i urin blir observert under visse forhold der vevsskade er veldig viktig. Den tidlige diagnostiske verdien for hjerteinfarkt kan diskuteres.
Kan tjene deg: cellekjerneMyoglobinstruktur
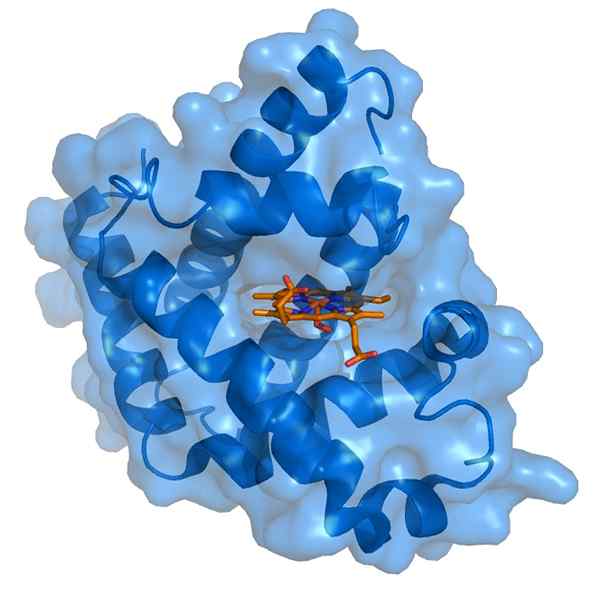 Myoglobin og dens hemo-protesegruppe (Kilde: Thomas Spletttsser/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons)
Myoglobin og dens hemo-protesegruppe (Kilde: Thomas Spletttsser/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0) via Wikimedia Commons) Myoglobin har en molekylvekt på nesten 18 kDa inkludert hemo -gruppen. Det er sammensatt av fire heliske segmenter forenet med "plutselige svinger". Disse myoglobinpropellene er tett pakket og opprettholder sin strukturelle integritet selv når hemokruppen er fjernet.
Strukturen til kuleproteiner, så vel som alle celleproteiner, er hierarkisk, så strukturen til myoglobin er også. Det første nivået er den primære strukturen dannet av den lineære sekvensen av aminosyrer og myoglobin består av en 153 aminosyrekjede.
Den sekundære strukturen til myoglobin består i dannelsen av alfa -propellen. Myoglobin inneholder 8 alfa -propeller dannet av gjentatte polypeptiddeler som binder seg ved korte aperiadiske styringssegmenter.
Den tertiære strukturen består av tre -dimensjonal konformasjon med biologisk aktivitet. De viktigste egenskapene til denne strukturen er sammenleggbart. Den kvartære strukturen refererer til montering av to eller flere separate og forente polypeptidkjeder gjennom ikke -kovalente koblinger eller interaksjoner.
Myoglobin har en veldig kompakt struktur, med hydrofobt avfall rettet mot interiøret og hydrofile eller polare rester rettet utover. Internt apolar avfall dannes av leucin, valin, metodin og fenylalanin. Det eneste indre polaravfallet er to histidiner som har funksjoner i det aktive senteret.
Hemo -protesegruppen er lokalisert i en kløve av den apolare indre delen av polyloglobin -polypeptidkjeden. Denne gruppen inneholder jern i form av jernholdig jern, som binder seg til oksygen for å danne oksimioglobin.
Kan tjene deg: GLUT4: Kjennetegn, struktur, funksjonerMyoglobin -funksjon
Myoglobinfunksjonen er å forene oksygen for hemokruppen i den. I den grad oksygen er fanget i strukturen til myoglobin i cytoplasmaet til muskelcellen, forblir dens intracellulære trykk, bestemt av fritt oksygen, lavt.
Det lave intracellulære oksygentrykket opprettholder gradienten for oksygeninnløp til cellen. Dette favoriserer passering av oksygen fra sirkulasjonsstrømmen til muskelcellen. Når myoglobin metter intracellulær oksygen øker, noe som gradvis reduserer gradienten og dermed reduserer overføringen.
Oksygenbindingskurven til myoglobin er hyperbolsk. I de første delene av kurven gir små endringer i delvis oksygentrykk store endringer i metning av myoglobin med oksygen.
I den grad delvis oksygentrykk øker metningen fortsetter å øke, men saktere, det vil si en mye større økning i det delvise oksygentrykket er nødvendig for å øke metningen av myoglobin, og gradvis flatet.
Det er en variabel som måler affiniteten til kurven som kalles P50, dette representerer det delvise trykket av oksygen som er nødvendig for å mette myoglobinet i en løsning med 50%. Så hvis P50 øker, sies det at myoglobin har mindre affinitet, og hvis P50 avtar, sies det at myoglobin har større affinitet for oksygen.
Kan tjene deg: proeritroblast: Kjennetegn, morfologi, regulering, fargingNår oksygenbindingskurvene med myoglobin og hemoglobin blir undersøkt, observeres det at for et hvilket som helst delvis oksygentrykk, er myoglobin mettet i stedet for hemoglobin, noe.
Typer muskelfibre og myoglobin
Skjelettmusklene har forskjellige typer muskelfibre i sammensetningen, noen sakte -kontraksjonssamtaler og andre med rask sammentrekning. Raske sammentrekningsfibre er strukturelt og metabolsk tilpasset seg raskt og kraftig og på en anaerob måte.
Sakte sammentrekningsfibre er tilpasset for lav hastighet, men mer langvarige sammentrekninger, typisk for aerob motstandsøvelser. En av de strukturelle forskjellene i disse fibrene er konsentrasjonen av myoglobin, noe som gir dem navnet på hvite og røde fibre.
Røde fibre har et høyt myoglobininnhold, noe som gir dem rød farge, men som også lar dem opprettholde store mengder oksygen, noe som er uunnværlig for deres funksjon.
Normale verdier
Normale blodverdier for menn er fra 19 til 92 ug/l og hos kvinner fra 12 til 76 ug/l, er det imidlertid forskjeller i verdier i forskjellige laboratorier.
Disse verdiene øker når muskelødeleggelse skjer som ved rabdomyolyse av skjelettmuskulatur, i omfattende forbrenninger, elektriske støt eller i omfattende muskelnekrose på grunn av arteriell okklusjon, i hjerteinfarkt og i noen myopatier.
Under disse forholdene vises myoglobin i urin og gir den en karakteristisk farge.

