Kvantemekanisk modell av atomet
- 3968
- 388
- Jonathan Moe
Hva er den kvantemekaniske modellen til atomet?
Han Kvantemekanisk modell av atomet Det antar at dette dannes av en sentral kjerne dannet av protoner og nøytroner. Elektronene, med negativ belastning, pakker kjernen i diffuse regioner kjent som orbitaler.
Formen og forlengelsen av elektroniske orbitaler bestemmes av flere størrelser: kjernepotensialet og kvantiserte nivåer av energi og vinkelmomentum av elektroner.
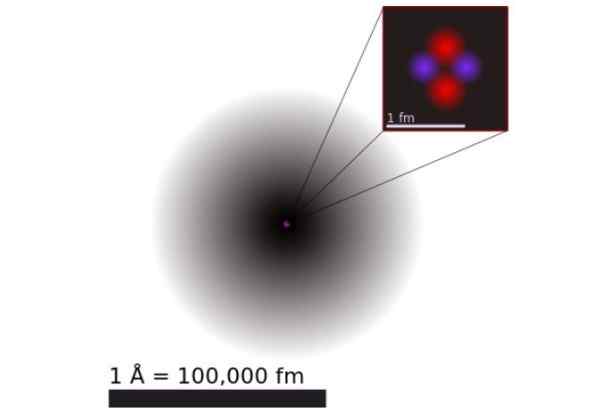
 Figur 1. Modell av et heliumatom i henhold til kvantemekanikk. Den består av sannsynlighetsskyen til de to heliumelektronene som omgir en positiv kjerne 100 tusen ganger mindre. Kilde: Wikimedia Commons.
Figur 1. Modell av et heliumatom i henhold til kvantemekanikk. Den består av sannsynlighetsskyen til de to heliumelektronene som omgir en positiv kjerne 100 tusen ganger mindre. Kilde: Wikimedia Commons. I henhold til kvantemekanikk har elektron. Dimensjonene til atomet bestemmes praktisk ved utvidelsen av elektroniske orbitaler som omgir den positive kjernen.
Figur 1 viser strukturen til heliumatom, som har en kjerne med to protoner og to nøytroner. Denne kjernen er omgitt av sannsynlighetsskyen til de to elektronene som omgir kjernen, som er hundre tusen ganger mindre. I følgende bilde kan du se heliumatom, med protonene og nøytronene i kjernen og elektronene i orbitaler.

Størrelsen på et heliumatom er i rekkefølgen av en angstrom (1 Å), det vil si 1 x 10^-10 m. Mens størrelsen på kjernen er i rekkefølgen av en femtometer (1 fm), det vil si 1 x 10^-15 m.
Til tross for at han er så liten relativt, er 99,9% av atomvekten konsentrert i den bittesmå kjernen. Dette er fordi protoner og nøytroner er 2000 ganger tyngre enn elektronene som omgir dem.
Kan tjene deg: de 31 typene kraft i fysikk og deres egenskaperAtomskala og kvanteatferd
Et av konseptene som hadde mest innflytelse på utviklingen av atommodellen var dualiteten Bølge - partikkel: Oppdagelsen at hvert materialobjekt har en bølge av materie assosiert.
Formelen som gjør at bølgelengden kan beregnes λ Tilknyttet et materielt objekt ble foreslått av Louis de Broglie i 1924 og er som følger:
λ = h / (m v)
Hvor h Det er Plancks konstant, m deigen og v hastighet.
I følge De Broglies prinsipp har hvert objekt en dobbel oppførsel, men avhengig av omfanget av interaksjoner, hastighet og masse, kan bølgeatferd være mer fremtredende enn partikkel eller omvendt.
Elektronet er lett, massen er 9,1 × 10^-31 kg. Den typiske hastigheten til et elektron er 6000 km/s (femti ganger mindre enn lysets hastighet). Denne hastigheten tilsvarer energiverdier i rekkevidden av dusinvis av elektron-voltio.
Med de tidligere dataene, og ved å bruke de Broglie -formelen, kan bølgelengden for elektronet oppnås:
λ = 6,6 x 10^-34 J s / (9,1 × 10^-31 kg 6 x 10^6 m / s) = 1 x 10^-10 m = 1 Å
Elektronet til de typiske energiene til atomnivåer, har en bølgelengde av samme størrelsesorden som den for atomskalaen, slik at den i den skalaen har ondskapsfull og ikke partikkeloppførsel.
Første kvantemodeller
Med ideen i tankene om at Atomic Scale Electron har bølgende oppførsel, ble de første atommodellene basert på kvanteprinsipper utviklet. Blant disse skiller Bohrs atommodell seg ut, som perfekt spådde hydrogenemisjonsspekteret, men ikke det av andre atomer.
Kan tjene deg: Spenningsinnsats: Formel og ligninger, beregning, øvelserBohrs modell og deretter den fra Sommerfeld, var semiklassiske modeller. Det vil si at elektronet var som en partikkel utsatt for den elektrostatiske attraksjonskraften til kjernen som går i bane rundt den, styrt av Newtons andre lov.
I tillegg til de klassiske banene, tok disse første modellene hensyn til at elektronet hadde en tilhørende materialbølge. Bare banene hvis omkrets var et heltall med bølgelengder var tillatt, siden de som ikke oppfyller dette kriteriet, bleknet av destruktiv interferens.
Det er da kvantisering av energi i atomstrukturen vises for første gang.
Ordet Kvantum nettopp kommer fra det faktum at elektronet bare kan ta noen diskrete energiverdier i atomet. Dette sammenfaller med Plancks funn, som besto av oppdagelsen at en frekvensstråling F Samhandle med materie i energipakker E = h f, hvor h Det er Plancks konstant.
Orbital form og størrelse
Det radielle omfanget av bane bestemmes av Radi bølgefunksjontil. Er større i den grad elektronens energi vokser, det vil si i den grad det viktigste kvantetallet øker.
Radialavstanden måles vanligvis i Bohr-radioer, som for den laveste hydrogenenergien er 5,3 x 10-11 m = 0,53 Å.
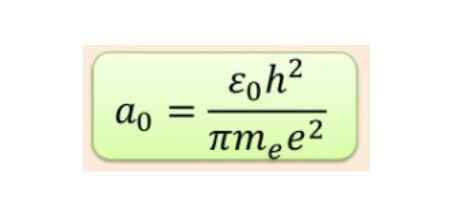 Figur 2. Bohr radiusformel. Kilde: f. Zapata.
Figur 2. Bohr radiusformel. Kilde: f. Zapata. Men formen til orbitaler bestemmes av verdien av kvantetallet av vinkelmomentum. Hvis L = 0 har du en sfærisk orbital kalt S, hvis L = 1 har du en lobet orbital kalt p, som kan ha tre orienteringer i henhold til magnetisk kvantetall. Følgende figur viser formen for orbitaler.
Kan tjene deg: vektorstørrelse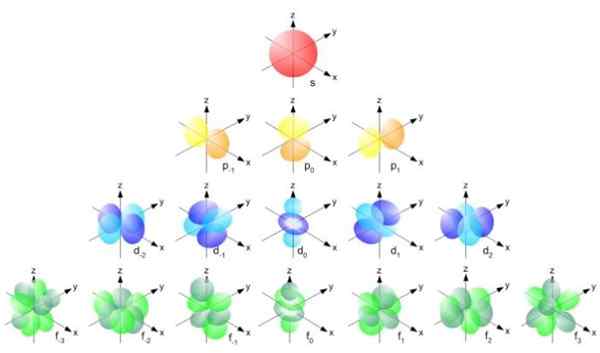 Figur 3. Form av orbitalene S, P, D, F. Kilde: Ucdavis Chemwiki.
Figur 3. Form av orbitalene S, P, D, F. Kilde: Ucdavis Chemwiki. Disse orbitalene er pakket i andre i henhold til energien til elektronene. For eksempel viser følgende figur orbitaler i et natriumatom.
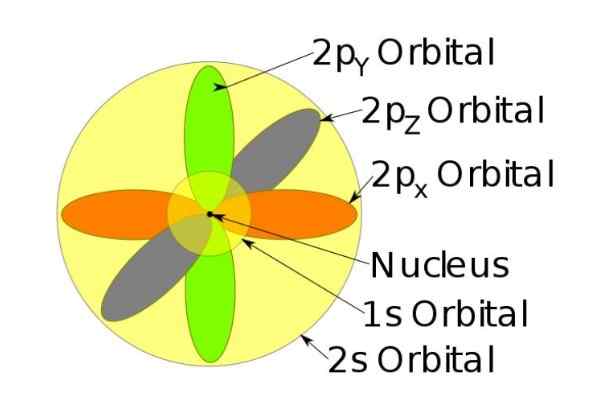 Figur 4. Orbitals 1s, 2s, 2p av natriumionen når det har mistet et elektron. Kilde: Wikimedia Commons.
Figur 4. Orbitals 1s, 2s, 2p av natriumionen når det har mistet et elektron. Kilde: Wikimedia Commons. Spinnet
Den kvantemekaniske modellen til Schrödinger -ligningen inneholder ikke elektronspinnet. Men Pauli blir tatt i betraktning gjennom eksklusjonsprinsippet, noe som indikerer at orbitaler kan befolke opptil to elektroner med kvantespinnnummer s = +½ og s = -½.
For eksempel har natriumionet 10 elektroner, det vil si hvis vi refererer til forrige figur, er det to elektroner for hver orbital.
Men hvis det er det nøytrale natriumatom, er det 11 elektroner, hvorav den siste ville okkupere en 3S -orbital (ikke vist på figuren og av større radius enn 2S). Spinnet til atomet er avgjørende i de magnetiske egenskapene til et stoff.
Referanser
- Alonso - Finn. Kvante- og statistiske fundamenter. Addison Wesley.
- Eisberg - Resnick. Kvantefysikk. Limusa - Wiley.
- Gasiorowicz. Kvantefysikk. John Wiley & Sons.
- HSC. Fysikkkurs 2. Jacaranda Plus.
- Wikipedia. Schrodinger Atomic Model. Gjenopprettet fra: Wikipedia.com

