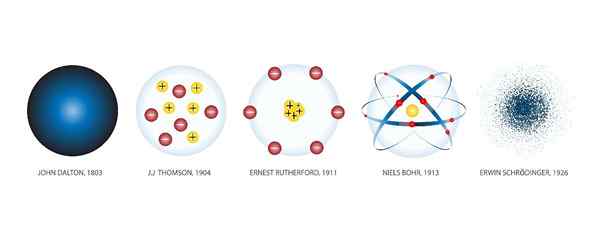
Atommodeller
- 4003
- 1254
- Prof. Oskar Aas
 Atommodeller er de forskjellige grafiske representasjonene som er gitt til atomer gjennom historien. Shuttersock
Atommodeller er de forskjellige grafiske representasjonene som er gitt til atomer gjennom historien. Shuttersock Hva er atommodeller?
De Atommodeller De er grafiske representasjoner av strukturen og driften av et atom. Det har vært mange modeller gjennom historien.
Dette er fordi ideen om atomet som en grunnleggende blokkering av hvilken materie er laget, ble født for tusenvis av år siden, i det gamle Hellas. På den tiden var atomet bare et produkt av filosofiske spekulasjoner.
Da nye vitenskapelige funn ble gjort, ble nye modeller laget for å innlemme kunnskapen som er tilegnet. Og slik har det skjedd århundre etter århundre til i dag, når teknologien har tillatt oss å observere atomer gjennom mikroskop og bestemme riktig modell.
Hva er atomer?
Atomene er submikroskopiske strukturer som alt det emnet vi oppfatter er dannet og som vi samhandler hver dag, fra vår egen kropp, maten vi spiser, klærne vi har på oss, til de store skyskrapere og fly.
Også solen, månen, planetene, stjernene og galaksene dannes med atomer.
Disse er så små at de ikke kan sees med vanlige mikroskop. Andre kreves av større kraft, kalt Ultramicroscopes. Atomer er imidlertid ikke de minste naturenhetene.
Atomer dannes i sin tur av enda mindre partikler: protoner, nøytroner og elektroner.
Protoner har positiv elektrisk ladning, mens nøytroner ikke har noen elektrisk lading. Disse to typene partikler danner atomets kjerne.
Å dreie seg rundt kjernen som planeter rundt solen er elektroner, som har en negativ elektrisk ladning.
Atomisk modell av demokritus

Democritus of Abdera var en gresk filosof som bodde mellom 460 og 370 før dagens tid. Han bekreftet at all materie ble dannet av bittesmå partikler han kalte atomer, som på gresk betyr udelbar.
I følge Democritus er atomet den minste delen som saken kan deles. Det er et uendelig antall av dem, som er uforgjengelig, utrolige, evige og absolutt kompakte, uten porer. Det er flere typer, som skiller seg etter form, størrelse, posisjon og måten de er villige.
Det kan tjene deg: Katastrofer forårsaket av mennesker når du bruker vitenskap og teknologiDemocritus 'teori ble avvist av Aristoteles og deretter helt glemt til fremveksten av moderne vitenskap.
Dalton Atomic Model

John Dalton (1766-1844) var en engelsk meteorolog som var interessert i å undersøke lovene som styrer gassatferd. Frukt av arbeidet hans på det feltet var den første atommodellen for moderne vitenskap, som han laget i 1803.
Siden eksistensen av protoner og elektroner ennå ikke hadde blitt oppdaget, sa Dalton, som Democritus, at atomet er den minste delen der materie kan deles og derfor i seg selv er det udelelig.
I følge Dalton er atomer solide og har en sfærisk form, som en baseballball. Dalton illustrerte teorien hans som hugger i tre, sammen med assistentene hans, dusinvis av sfærer som representerte atomer av forskjellige kjemiske elementer.
Denne modellen var i kraft til oppdagelsen av elektronet.
Thomson Atomic Model
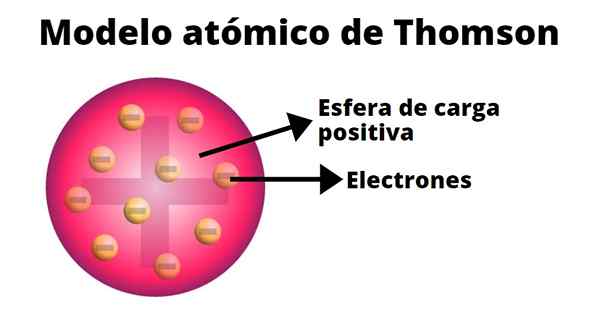
Den engelske fysikeren Joseph John Thomson (1865-1940) måtte gjøre et av de viktigste funnene i moderne vitenskap: det av elektronet.
Det var i 1897, i Cavendish Laboratory ved University of Cambridge, i England, hvor en plakett fremdeles minnes Great Discovery.
Thompson og hans assistenter projiserer en katodestråler på et elektrisk felt. Ved kontakt med feltet avviket strålene å danne brede vinkler. Dette bekreftet at katodestråler hadde en negativ elektrisk ladning. De negativt ladede partiklene kalte dem elektroner.
Thomson antok at elektronene var innebygd i atomer. Hans atommodell stammer fra 1904.
Pudding av rosiner
I Thompsons atommodell er atom. Derfor ble denne modellen kjent som "Pudin de Pasas".
I følge Thompson har atomet en radius på 0,00000001 centimeter og belastningen er nøytral, siden protoner og elektroner har samme belastning, men av motsatt tegn.
Thompson -modellen presenterer ikke nøytroner.
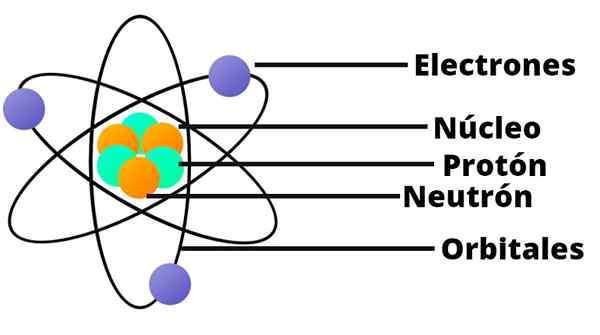
Rutherford Atomic Model
Ernest Rutherford (1871-1937), en Neozylean-fysiker, var en av Thomsons mest fremtredende studenter.
Kan tjene deg: korrelasjonsforskningI 1911, og basert på den da nylige oppdagelsen av radioaktivitet, gjennomførte Rutherford følgende eksperiment: De avfyrte alfa radioaktive partikler med høy hastighet og energi mot et ark med gull.
Hvis Atomic -modellen Thompson var riktig, ville alfapartiklene passere gjennom arket uten å avvike eller med et ubetydelig avvik. Men når de beregnet avviksvinkelen fra partiklene, oppdaget de at den var bred, og at noen til og med spretter mot det gyldne arket.
Med dette resultatet forsto Rutherford at atomet skulle ha en veldig liten og sterkt kondensert kjerne. Denne kjernen ble positivt ladet.
Et lite solsystem
Rutherfords atommodell er som et miniatyr solsystem. I sentrum, på det stedet som vil samsvare med solen, er det kjernen med sine positivt lastede protoner. Rundt dette, bane som planeter, er det tilfeldig distribuerte elektroner.
Rutherford slo også fast at atomets masser tilsvarer summen av elektron- og protonmassene.
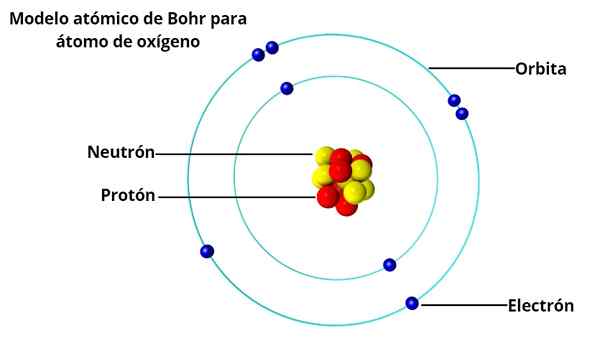
Bohr atommodell
Selv om Rutherford -modellen var et ubestridelig fremskritt med hensyn til tidligere modeller, hadde den viktige feil. For eksempel, hvis elektronene effektivt orbital rundt kjernen, ville de ende opp med å miste energi og kollapse på kjernen. Men dette skjedde tydeligvis ikke.
Det var den danske fysikeren Niels Bohr (1885-1962), en student ved Rutherford ved University of Manchester (England), som i 1913 ville foreslå en atommodell som løste problemene som hans gamle professor ga.
Sirkulære baner
I atommodellen til Bohr går ikke elektroner fritt rundt kjernen, men gjør det i stabile sirkulære baner, atskilt fra hverandre med en vis. Hver bane kalles energi- eller energinivået.
Basert på undersøkelsene av Max Planck og Albert Einstein, bestemte han at hvert elektron i bane har en viss energi.
Mens de går i bane rundt stabelen rundt kjernen, sies det at elektroner er i stasjonær tilstand. På den annen side, når et elektron "hopper" til en lavere energibane, er det et foton.
Kan tjene deg: MetodikkBohr -modellen var imidlertid ikke vellykket med å forklare driften av atomer med mer enn ett elektron.
Sommerfeld Atomic Model
Arnold Sommerfeld (1868-1951) var en tysk fysiker som dedikerte arbeidet sitt til å utvide Bohrs atommodell. Denne utvidede modellen ble presentert i 1916.
Basert på Einsteins relativitetsteori, oppdaget Sommerfeld at noen elektroner går i bane rundt kjernen i hastigheter nær lys (300.000 kilometer per sekund).
Han foretok også følgende modifikasjoner av Bohr -modellen:
- Elektronene beveger seg rundt kjernen i sirkulære og elliptiske baner. Bohr anerkjente bare sirkulære baner.
- Innenfor samme energinivå er det undernivåer med litt forskjellige energier.
Kvantemekanisk modell (Broglie, Heisenberg og Schrödinger)
Dette er den mest nøyaktige atommodellen som er kjent og for øyeblikket aksepteres, med noen påfølgende tillegg. Det ble utviklet av tre forskere: Den tyske Werner Heisenberg (1901-1976), den østerrikske Erwin Schrödinger (1887-1961) og franskmannen Louis de Broglie (1892-1987).
Denne modellen forkaster ideen om elektroner som går i bane rundt kjernen. I stedet har vi elektroniske skyer, som er mellomrom rundt kjernen der det er mulig å finne et elektron. Dette oppfører seg som en stasjonær bølge.
Sannsynligheten for å finne den beregnes med en ligning etablert av Schrödinger.
Dette er den kvantemekaniske modellen til atomet som startet fra Schrödinger -ligningen. Med denne ligningen kan du vite sannsynligheten for å finne et elektron på et bestemt punkt av et atom.
I denne modellen beveger hvert elektron i en spesifikk retning, som bestemmes av fire kvantetall, som er: hovedkvantumnummer, sekundært kvantetall, magnetisk kvantetall og kvantetall.
Det er ingen to elektroner som har identiske kvantetall, som det er uttalt av eksklusjonsprinsippet oppdaget av fysikeren Wolfgang Pauli.
Referanser
- (2010). Atom. Moderne leksikon britisk.
- (s. F.). Democritus Atomic Model, Philosophical Atomism. Hentet fra energi-kjernefysisk.nett.
- (s. F.). Sommerfeld Atomic Model, Expansion til Bohr -modellen. Hentet fra energi-kjernefysisk.nett.
- Bertsch, g. F.; Trefil, James og McGrayne, Sharon Bertsch (2021). Atom. Britannica Encyclopedia. Hentet fra Britannica.com.
- Duignan, f. (2021). Demokritus. Britannica Encyclopedia. Hentet fra Britannica.com.
- New World Encyclopedia bidragsytere. (2021). Atom. Hentet fra Newworldyclopedia.org.
- Zita, Ana. (s. F.). Atommodeller. Hentet fra todamateria.com.

