Apolare molekyler
- 1275
- 20
- Anders Mathisen
De Apolare molekyler De er de som presenterer i sin struktur en symmetrisk fordeling av elektronene sine. Dette er mulig hvis elektronegativitetsforskjellen på atomene er liten, eller hvis atomer eller elektronegative grupper avbryter effekten av molekylet på molekylet.
Ikke alltid "apolaritet" er absolutt. Av den grunn anses dårlige polaritetsmolekyler for å være apolar; det vil si at det har et dipolmoment µ nær 0. Her kommer du inn i det relative feltet: hvor lavt skal µ være slik at et molekyl eller forbindelse anses som apolar?
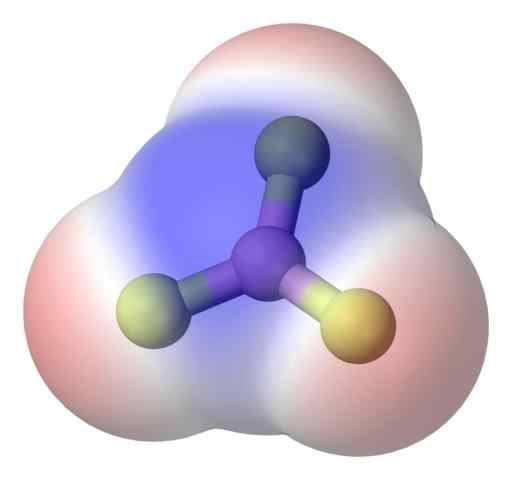
 BF3 apolar molekyl. Kilde: Benjah-BMM27 via Commons Wikimedia.
BF3 apolar molekyl. Kilde: Benjah-BMM27 via Commons Wikimedia. For bedre å løse problemet, har du bor trifluoridmolekylet, BF3 (Øvre bilde).
Fluoratomet er mye mer elektronegativ enn Boros, og derfor er B-F-koblingene polare. Imidlertid BF -molekylet3 Det er symmetrisk (trigonalt plan) og innebærer vektoravbestillingen av de tre B-F-øyeblikkene.
Dermed genereres også apolare molekyler, selv med eksistensen av polare koblinger. Polariteten som genereres kan balanseres av eksistensen av en annen polar kobling, av samme størrelse som den forrige, men orienteres i motsatt retning; Som tilfellet er i BF3.
Kjennetegn på et apolært molekyl
Symmetri
For at effekten av polare koblinger skal avbryte hverandre, må molekylet ha en spesifikk geometrisk struktur; For eksempel lineær, den enkleste å forstå ved første øyekast.
Dette er tilfellet med karbondioksid (CO2), som har to polare lenker (o = c = o). Dette er fordi de to dipolmomentene på koblingene C = O blir kansellert når den ene er orientert til den ene siden, og den andre mot den andre, i en vinkel på 180 °.
Kan tjene deg: transamineringDerfor er en av de første egenskapene som tar hensyn til når "apolariteten" av et molekyl evalueres med fugleflukt, å observere hvor symmetrisk det er.
Anta at i stedet for CO2 Du har molekylet cos (o = c = s), kalt karbonylsulfid.
Nå er det ikke lenger et apolært molekyl, siden svovelelektronegativitet er mindre enn oksygen; Og derfor er dipolmomentet C = S forskjellig fra C = O. Som et resultat er COS et polært molekyl (polaren er et mel av en annen sekk).
Det nedre bildet oppsummerer grafisk alt nylig beskrevet:
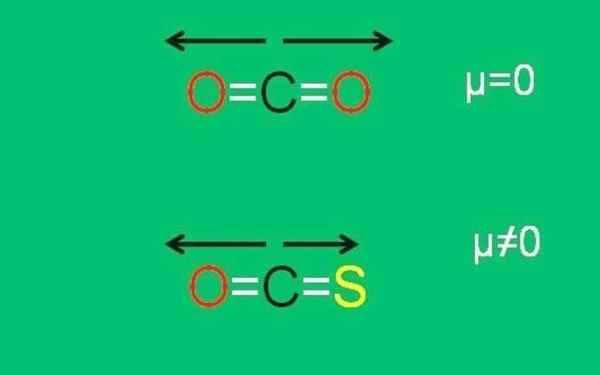 Xxx dipolare øyeblikk av CO2- og COS -molekyler. Kilde: Gabriel Bolívar.
Xxx dipolare øyeblikk av CO2- og COS -molekyler. Kilde: Gabriel Bolívar. Merk at dipolmomentet til lenken C = S er mindre enn lenken C = O i COS -molekylet.
Elektronegativitet
Elektronegativitet på Pauling -skalaen har verdier mellom 0,65 (for Francio) og 4,0 (for fluor). Generelt har halogener høy elektronegativitet.
Når forskjellen i elektronegativiteten til elementene som danner en kovalent binding er mindre enn 0,4, sies det at den er apolar eller ikke polar. Imidlertid er de eneste molekylene som virkelig er apolar, de som er dannet av koblinger mellom identiske atomer (for eksempel hydrogen, H-H).
Intermolekylære krefter
For at et stoff skal oppløses i vannet, må det samhandle elektrostatisk med molekylene; interaksjoner som ikke kan utføre apolare molekyler.
I apolare molekyler er deres elektriske ladninger ikke innesperret i den ene enden av molekylet, men symmetrisk fordelt (eller homogent). Derfor klarer han ikke å samhandle gjennom dipol-dipolo-styrker.
Kan tjene deg: atomvolumI stedet interagerer apolare molekyler med hverandre gjennom spredningskrefter i London; Dette er øyeblikkelig dipoler som polariserer den elektroniske skyen av nabo molekyler atomer. Her er molekylmassen en dominerende faktor i de fysiske egenskapene til disse molekylene.
Hvordan identifisere apolare molekyler?
-Kanskje en de beste metodene for å identifisere et apolært molekyl er dets løselighet i forskjellige polare løsningsmidler, og er generelt lite løselig i dem.
-Generelt sett er apolare molekyler av gassform. De kan også være upåvirkede væsker med vann.
-Apolare faste stoffer er preget av å være myke.
-Spredningskreftene som holder dem sammen er vanligvis svake. På grunn av dette har smelte- eller kokepunktene en tendens til å være lavere enn polare forbindelser.
-Apolare molekyler, spesielt i flytende form, er dårlige elektrisitetsledere, siden de mangler netto elektrisk lading.
Eksempler på apolare molekyler
Edle gasser
Selv om de ikke er molekyler, anses edelgasser som apolar. Hvis det antas at to av atomene samhandler i en kort perioder, kan denne interaksjonen betraktes (halvparten) som et molekyl; molekyl som ville være apolar natur.
Diatomiske molekyler
Diatomiske molekyler, for eksempel h2, Br2, jeg2, CL2, o2, og f2, De er apolare. Disse er generelt2, A-A.
Hydrokarboner
Hva om det var en gruppe atomer? Det ville være før andre apolare forbindelser; For eksempel etan, cho3-Ch3, hvis karbonskjelett er lineært, C-C.
Metano, kap4, og etanen, C2H6, De er apolare molekyler. Karbon har en elektronegativitet på 2,55; Mens hydrogenelektronegativitet er 2,2. Derfor er det en dipolvektor med lav intensitet, orientert fra hydrogen til karbon.
Det kan tjene deg: MOHR -metode: grunnleggende, reaksjoner, prosedyre, brukMen på grunn av den geometriske symmetrien til metan- og etanmolekyler, er summen av dipolvektorer eller dipolmomenter i molekylene deres ugyldige, så det er ingen nettbelastning i molekylene.
Generelt skjer det samme med alle hydrokarboner, og selv når det er umettethet i dem (doble og trippelbindinger), regnes de som apolare eller forbindelser med lav polaritet. Sykliske hydrokarboner er også apolare molekyler, for eksempel cyclohexan eller cyclobutane.
Andre
Karbondioksidmolekyler (CO2) og karbondisulfid (CS2) De er apolare molekyler, begge med en lineær geometri.
I karbondisulfid er karbonelektronegativitet 2,55, mens svovelelektronegativitet er 2,58; Så begge elementene har praktisk talt den samme elektronegativiteten. Det er ingen generasjon av en dipolvektor, og derfor er nettlasten null.
Følgende CCL -molekyler er også tilgjengelige4 og Albr3, begge apolar:
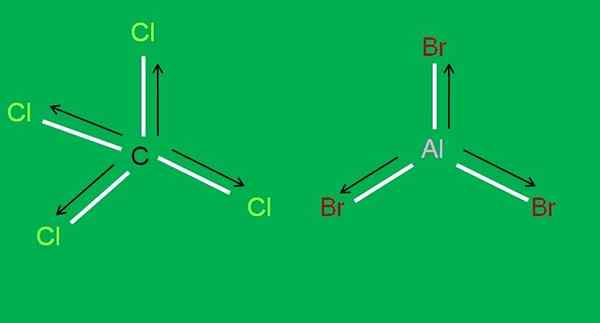 CCL4 og ALBR3 molekyler. Kilde: Gabriel Bolívar.
CCL4 og ALBR3 molekyler. Kilde: Gabriel Bolívar. I aluminium tribromid, Albb3 Det samme skjer med BF3, I begynnelsen av artikkelen. I mellomtiden, for karbontetraklorid, CCL4, Geometri er tetrahedral og symmetrisk, siden alle C-CL-koblinger er like.
Tilsvarende molekyler med den generelle formelen CX4 (Jfr4, CI4 og CBR4), de er også apolare.
Og til slutt kan et apolar molekyl til og med ha oktaedrisk geometri, som tilfellet er med svovelheksafluorid, SF6. Faktisk kan du ha noen geometri eller struktur, så lenge den er symmetrisk og dens elektroniske fordeling er homogen.
Referanser
- Ikke -polært molekyl. Gjenopprettet fra: Kjemi.Tutorvista.com
- Eksempel på polare og ikke -polare molekyler. Gjenopprettet fra: Thoughtco.com
- « Balanse av materie hva som er, generell ligning, typer
- Daniel Servitje Montull Biografi, ledelse og bidrag »

