Dipolar øyeblikk hvordan det blir beregnet og eksempler

- 978
- 22
- Daniel Skuterud
Han Dipolar øyeblikk Det er en kjemisk egenskap som indikerer hvor heterogent de elektriske ladningene er distribuert i et molekyl. Det kommer til uttrykk i Debye -enheter, 3,33 · 10-30 C · m, og vanligvis varierer verdiene deres fra 0 til 11 d.
Svært polare forbindelser har en tendens til å ha store dipolmomenter; Mens de apolare, små dipolmomentene. Jo mer polariserte elektriske ladninger er i et molekyl, jo større er dipolmomentet; det vil si at det må være en region rik på elektroner, Δ- og en annen dårlig i elektroner, Δ+.
 Det to -fargede utkastet fungerer som en analogi til to stolper, positive og negative, av et molekyl med et markert dipolmoment. Kilde: Pexels.
Det to -fargede utkastet fungerer som en analogi til to stolper, positive og negative, av et molekyl med et markert dipolmoment. Kilde: Pexels. Dipolmomentet, μ, er en vektorstørrelse, så det påvirkes av vinklene på koblingene og generelt av molekylstrukturen.
Når molekylet er lineært, kan det sammenlignes med et tofarget trekk. Dens negative ende Δ-, den ville tilsvare den røde fargen; Mens det positive, Δ+, ville være den blå fargen. Når størrelsene på negative belastninger øker i Δ-polen, og avstanden som skiller den fra Δ+, øker dipolmomentet.
Kjemisk betyr ovennevnte at jo større forskjell i elektronegativitet mellom to atomer, og jo lengre avstand som skiller dem, desto større er dipolmomentet mellom dem.
[TOC]
Hvordan beregnes dipolmomentet?
Det regnes som en kovalent kobling mellom to atomer, A og B:
A-B
Avstanden mellom positive og negative delvise belastninger er allerede definert av lengden på koblingen:
TILΔ+-BΔ-
Fordi protoner og elektroner har samme størrelse med elektrisk ladning, men med motsatte tegn, 1.6 · 10-19C, dette er den som tas i betraktning når du evaluerer dipolmomentet mellom A og B gjennom følgende ligning:
Det kan tjene deg: forskjeller mellom organiske og uorganiske forbindelserμ = Δ ·d
Hvor μ er dipolmomentet, er Δ belastningen på elektronet uten det negative tegnet, og d Lengden på lenken uttrykt i meter. For eksempel forutsatt det d Den har en verdi på 2 Å (1 · 10-10m) Dipolmomentet, μA-B vil være:
μA-B = (1.6 · 10-19C) · (2 · 10-10m)
= 3,2 · 10-29C · m
Men siden denne verdien er veldig liten, brukes Deby -enheten:
μ = (3,2 · 10-29C · m) · (1 d/3,33 · 10-30 C · m)
= 9,60 d
Denne μA-B-verdien kan anta at A-B-koblingen er mer ionisk enn kovalent.
Eksempler
Vann
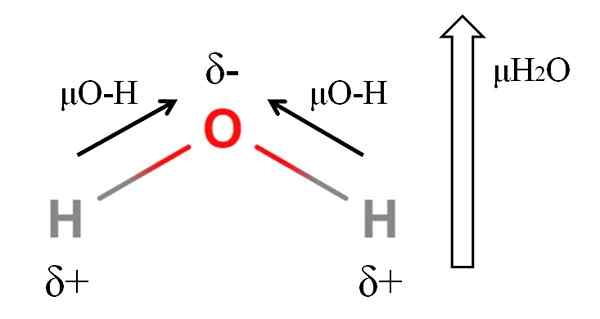 DiPoar Moment of a Water Molecule. Kilde: Gabriel Bolívar.
DiPoar Moment of a Water Molecule. Kilde: Gabriel Bolívar. For å beregne dipolmomentet til et molekyl, må du legge til alle dipolmomentene i deres respektive koblinger, med tanke på vinklene på koblinger og litt trigonometri. Dette med det første.
Vann har et av de største dipolmomentene som kan forventes for en kovalent forbindelse. I det øvre bildet har vi at hydrogenatomer har positive delvise belastninger, Δ+, mens oksygenet bærer den negative delvise belastningen, Δ-. O-H-koblingen er ganske polar (1.5d), og det er to av dem i et H -molekyl2ENTEN.
Generelt trekkes en vektor fra det mindre elektronegative atomet (H) til det mest elektronegative (O). Selv om de ikke er trukket, er det på oksygenatomet to par ikke delte elektroner, som "konsentrerer" den negative regionen enda mer.
På grunn av vinkelgeometrien til h2Eller, dipolmomentene blir med i retning av oksygenatom. Merk at summen av de to μo-H vil gi 3D (1.5+1.5); Men det er ikke sånn. Dipolmomentet med vann har en eksperimentell verdi på 1.85d. Her er effekten av den nære vinkelen på 105º mellom H-O-H-koblingene.
Det kan tjene deg: Laboratorytermometer: Kjennetegn, hva er det for, bruk, eksemplerMetanol
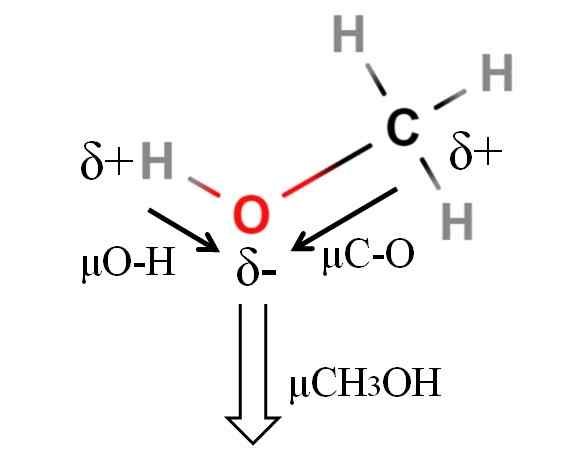 DiPoar Moment of a Methanol Molecule. Kilde: Gabriel Bolívar.
DiPoar Moment of a Methanol Molecule. Kilde: Gabriel Bolívar. Metanolens dipolmoment er 1.69d. Er mindre enn vann. Derfor har ikke atommasser for stor innflytelse i dipolmomentet; Men atomradioene hans. Når det gjelder metanol, kan vi ikke bekrefte at H-O-lenken din har en μ lik 1.5 d; Siden er molekylære miljøer forskjellige i CHO3Å og h2ENTEN.
Det er grunnen til at vi må måle lengden på H-O-koblingen i metanolen for å kunne beregne μo-H. Det som kan bekreftes er at μO-H er større enn μC-O.
Metanol er katalogisert som et av de mest polare løsningsmidlene som finnes sammen med vann og ammoniakk.
Ammoniakk
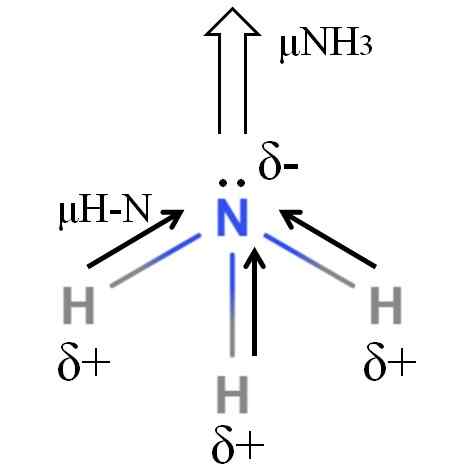 DiPoar Moment of a Ammoniak Molecule. Kilde: Gabriel Bolívar.
DiPoar Moment of a Ammoniak Molecule. Kilde: Gabriel Bolívar. H-N-bindinger er ganske polare, så nitrogen etter dets større elektronegativitet tiltrekker elektroner mot seg selv (overlegen bilde). I tillegg til dette, har vi på ham et par upaktede elektroner, som bidrar med deres negative belastninger til Δ -regionen-. Derfor dominerer elektriske ladninger i ammoniakkens nitrogenatom.
Ammoniakk har et dipolmoment på 1.42d, mindre enn metanol. Hvis både ammoniakk og metanol kunne transformeres til utkast, vil det sees at utkastet til metanolen har mer definerte poler sammenlignet med utkastet til ammoniakk.
Etanol
I tilfelle av etanol, Cho3Ch2Åh ditt dipolmoment er veldig nær metanol, men det har en tendens til å ha lavere verdier. Å ha flere karbonatomer som komponerer δ+-regionen, oksygenatom som representerer Δ-, begynner å miste litt av sin "relative negative intensitet".
Kan tjene deg: Dimethylamine ((CH3) 2NH): Struktur, egenskaper, bruksområder, risikoKarbondioksid
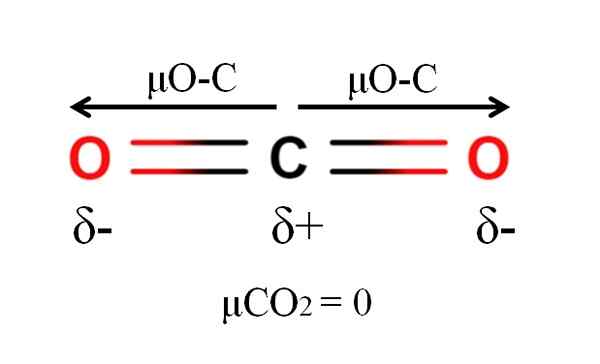 DiPoar Moment of a Carbon Dioxide Molecule. Kilde: Gabriel Bolívar.
DiPoar Moment of a Carbon Dioxide Molecule. Kilde: Gabriel Bolívar. Karbondioksid har to polare bindinger, C = O, med sine respektive dipolmomenter μo-C. Imidlertid, som det kan sees i det overordnede bildet, er den lineære geometrien til CO2 Gjør de to μO-C vektorisk avbryt hverandre, selv om karbonet har en positiv delvis belastning og oksygen-negative delvise belastninger.
Av denne grunn er karbondioksid et apolært molekyl, fordi μCo2 har en verdi av 0D.
Metan
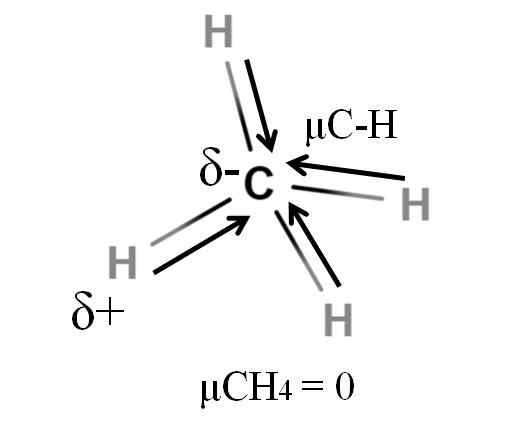 Dipolar øyeblikk for et metanmolekyl. Kilde: Gabriel Bolívar.
Dipolar øyeblikk for et metanmolekyl. Kilde: Gabriel Bolívar. Både metan og karbondioksid deler noe til felles: de er svært symmetriske molekyler. Generelt sett, jo mer symmetrisk et molekyl, jo mindre vil dipolmomentet være.
Hvis vi ser molekylet til Chos4, C-H-bindinger er polare, og elektronene er rettet mot karbonatomet fordi de er litt mer elektronegative. Det kan antas at karbon måtte være en svært negativ Δ -region; som et utkast med det intense røde senteret og den blålige ender.
Men når CHO er delt4 I to ville vi skaffe oss to H-C-H-halvdeler, den ene til venstre og den andre høyre, lik molekylet H2ENTEN. Dermed blir dipolmomentet som følge av å legge til disse to μc-h kansellert med den for den andre halvparten. Og derfor μch4 har en verdi av 0D.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Walter J. Moore. (1963). Fysisk kjemi. I kjemisk kinetikk. Fjerde utgave, Longmans.
- Iran. Levine. (2009). Prinsipper for fysikjemi. Sjette utgave, side 479-540. Mc Graw Hill.
- Helmestine, Anne Marie, PH.D. (29. januar 2020). Dipole Moment Definition. Gjenopprettet fra: Thoughtco.com
- Blaber Mike. (29. september 2019). Dipolmomenter. Kjemi librettexts. Gjenopprettet fra: Chem.Librettexts.org
- Larita Williams. (2020). Dipole Moment: Definisjon, ligning og eksempel. Studere. Gjenopprettet fra: Studie.com
- Wikipedia. (2020). Bond Dipole Moment. Hentet fra: i.Wikipedia.org
- « Gaslighting hvordan du kan oppdage det og 5 tips for å unngå det
- Onomatopoeia egenskaper, funksjon, typer, eksempler »

