Bariumnitrat kjemisk struktur, bruksområder, egenskaper

- 3336
- 435
- Anders Mathisen
Han Bariumnitrat Det er et salt sammensatt av et bariumatom (BA) og nitration (nei3). Det presenteres som et hvitt krystallinsk fast stoff ved romtemperatur og eksisterer i naturen som et veldig sjeldent mineral kjent som nitrobarita. Egenskapene gjør det til en giftig forbindelse som må administreres nøye.
Faktisk har denne forbindelsen flere bruksområder i militærindustrien, siden den kan knyttes til andre kjemiske stoffer og tilsettes eksplosive og brennende formuleringer, blant andre.
 Bariumnitratutseende. Kilde: w. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)
Bariumnitratutseende. Kilde: w. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0) [TOC]
Formel
Bariumnitrat, også kalt bariumdyitrat, har den kjemiske formelen BA (nei3)2, og produseres vanligvis gjennom to metoder.
Den første av disse innebærer oppløsning av små biter av bariumkarbonat (Bacchus3) I et medium -acidic medium (HNO3, en svært etsende mineralsyre), slik at jernforurensninger kan utfelle, og deretter blir denne blandingen filtrert, fordampet og krystallisert.
Den andre metoden gjøres gjennom kombinasjonen av bariumklorid (BACL2, En av bariumsaltene med større løselighet i vannet) med en forvarmet løsning av natriumnitrat. Dette genererer en reaksjon som resulterer i separasjon av blandingsbariumnitratkrystaller.
Kjemisk struktur av bariumnitrat
Dette saltet presenterer kjennetegn på kubisk krystallinsk struktur eller vannfri octaedros.
Den kjemiske strukturen er som følger:
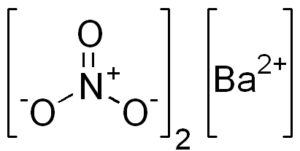
Dissosiasjon
Ved høye temperaturer (592 ºC) dekomponerer bariumnitrat for å danne bariumoksid (BAO), nitrogendioksid (nei2) og oksygen (eller2), I henhold til følgende kjemiske reaksjon:
Kan tjene deg: Berylhydroksid (BE (OH) 2)2BA (nei3)2 + Varme → 2BAO + 4NO2 +ENTEN2
I medier med høye konsentrasjoner av nitrogenoksid (NO) produserer nedbrytningen av bariumnitrat en forbindelse som kalles bariumnitritt (BA (nei2)2), I henhold til følgende ligning:
Baderom3)2 + 2no → Ba (nei2)2 + 22
Reaksjoner med oppløselig metall eller svovelsyresulfater (h2SW4) Generer bariumsulfat (Baso4). De aller fleste uoppløselige bariumsalter, for eksempel karbonat (Bacchus3), Oksalat (BAC2ENTEN4) eller metallfosfat (BA3(PO4)2), blir utfelt av lignende dobbeltnedbrytningsreaksjoner.
Bariumnitrat bruker
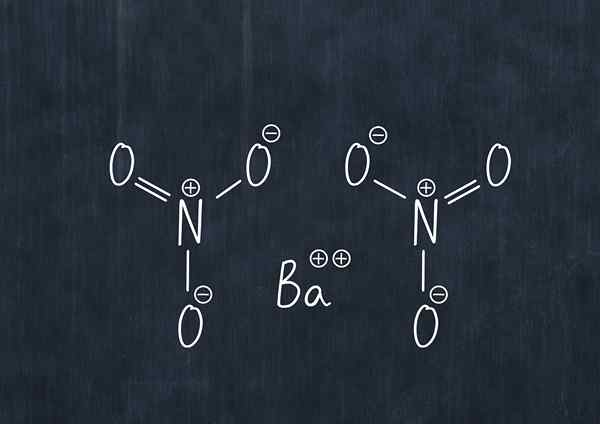 Kjemisk formel av bariumnitrat
Kjemisk formel av bariumnitrat Dette stoffet i støv er et oksidasjonsmiddel og reagerer betydelig med vanlige reduksjonsmidler.
Når dette saltet blandes med andre metaller, for eksempel aluminium eller sink i de findelte former, eller med legeringer som aluminiumsmagn0esio, slås det på og utnytter effekten. Av denne grunn regnes bariumnitrat som en utmerket del av militære våpen og eksplosiver.
Sammen med trinitrotoluen (kommersielt kjent som TNT, eller C6H2(NEI2)3Ch3) og et bindemiddel (regelmessig parafinvoks), danner dette saltet en forbindelse kalt baratol, som har eksplosive egenskaper. Den høye tettheten av bariumnitrat får Baratol til å skaffe seg en større tetthet, noe som gjør den mer effektiv i sin funksjon.
Bariumnitrat blir også sammen med aluminiumstøv, en formel som resulterer i dannelse av blinkende krutt, som hovedsakelig brukes i fyrverkeri og teaterpyroteknikk.
Dette blinket har også sett bruksområder i produksjonen av fakler (for eksempel antimile målinger av fly) og i lamslåtte granater. I tillegg er dette stoffet svært eksplosivt.
Det kan tjene deg: natriumcyanid (NACN): struktur, egenskaper, risikoer, brukDette saltet er kombinert med reaktantblandingen kalt termitt for å danne en variant av denne såkalte betegnelsen, som genererer korte og veldig kraftige blink av høye temperaturer i små områder i kort tid.
Termat-TH3 er en betegnelse som inneholder en 29 % sammensetning med bariumnitratvekt, noe som hjelper til.
Theroots brukes vanligvis i produksjonen av brennende granater og har funksjonen til å ødelegge militær tank rustning og strukturer.
I tillegg var bariumnitrat en av de mest brukte ingrediensene i produksjonen av brennende anklager som ble brukt av britene i sine krigsfly under andre verdenskrig, som bevæpnet med brennende ammunisjon som tjente til å ødelegge fiendens fly.
Til slutt har dette saltet bruk i produksjonsprosessen med bariumoksyd, i termionisk ventilindustri, og som allerede sagt, i opprettelsen av pyroteknikk, spesielt de i grønne farger.
Fysiske og kjemiske egenskaper
 Bario Bai Nitrato (NO3) 2
Bario Bai Nitrato (NO3) 2 Salt presenteres som et hvitt, hygroskopisk og toalett fast stoff, som er lite oppløselig i vann og helt uoppløselig i alkoholer.
Den har en molmasse på 261,337 g/mol, en tetthet på 3,24 g/cm3 og et fusjonspunkt på 592 ºC. Når det når kokepunktet, brytes det sammen, som det er sagt ovenfor. Ved romtemperatur har den vannløselighet på 10,5 g/100 ml.
Det regnes som stabilt, men det er et sterkt oksidasjonsmiddel og må være borte fra brennbare materialer for å unngå brann. Den har vannfølsomhet og skal ikke blandes med syrer eller vannfri.
Kan tjene deg: adsorpsjonsisotermer: konsept, typer, eksemplerI høye konsentrasjoner (for eksempel containere) må isoleres fra stoffer som kan få den til å reagere, siden det kan utnytte voldsomt.
Som enhver annen løselig forbindelse av barium, er det et giftig stoff for dyr og mennesker.
Det bør ikke inhaljeres eller konsumeres, siden symptomer på forgiftning (spesielt herding av ansiktsmuskler), oppkast, diaré, magesmerter, muskel skjelvinger, angst, svakhet, luftveisnød, hjerteuregelmessighet og anfall og anfall.
Døden kan oppstå etter en forgiftning med dette stoffet, noen timer eller noen dager etter å ha presentert.
Innånding av bariumnitrat genererer irritasjon i luftveisslimhinnen, og i begge forgiftninger må løsninger av sulfatsalter være forberedt på å bruke førstehjelp på de berørte.
Ved søl må den isoleres fra brennbare stoffer og materialer, og i tilfeller av brann skal du aldri komme i kontakt med tørre kjemikalier eller skum. Området må oversvømmes med vann hvis brannen er større.
Referanser
- Mabus. (s.F.). Sciencemadness. Hentet fra vitenskapelighet.org
- United States Inceniary Bomb Th3-M50a3. (s.F.). Hentet fra ammunisjonssider.com
- Cameo Chemicals. (s.F.). Oppnådd fra comeokjemikalier.NOAA.Gov
- Chemspider. (s.F.). Hentet fra Chemspider.com

