Nitrobenzen (C6H5NO2) struktur, egenskaper, bruksområder, risikoer

- 3714
- 359
- Jonathan Moe
Han nitrobenzen Det er en aromatisk organisk forbindelse dannet av en benzenisk ring C6H5- Og en nitro -ingen gruppe2. Dens kjemiske formel er C6H5NEI2. Det er en fargerik eller blekgul fet væske, med en lukt av bitre mandler eller sko for sko.
Nitobenzen er en veldig nyttig forbindelse i den kjemiske industrien fordi den gjør det mulig å få en serie kjemiske stoffer som har variert bruk. Dette er fordi det kan bli gjenstand for forskjellige typer reaksjoner.
 Nitrobencene, ca6H5-NEI2. Forfatter: Marilú Stea.
Nitrobencene, ca6H5-NEI2. Forfatter: Marilú Stea. Blant de viktige kjemiske reaksjonene er nitrering (som lar deg legge til flere grupper -ikke2 til molekylet) og reduksjonen (det motsatte av oksidasjon som de to oksygenatomene i nitrogruppen -Nei elimineres2 og erstattes av hydrogener).
Med nitrobencene kan du forberede for eksempel anilin og para-acetaminophenol. Det siste er den velkjente acetaminophen som er et antipyretisk (febermedisiner) og myk smertestillende (mindre smertemedisin).
Nitobenzen må manipuleres med forsiktighet fordi det er irriterende og giftig, det kan forårsake en type anemi, blant flere symptomer, og det antas at det kan forårsake kreft. Det er også skadelig for miljøet.
[TOC]
Struktur
Nitrobenzen c6H5-NEI2 Det er et flatt molekyl dannet av en benzenisk ring C6H5- som en nitrogruppe er koblet til -ikke2. Molekylet er flatt fordi det er en elektronisk interaksjon mellom nitro -ingen -gruppen2 og benzenringen.
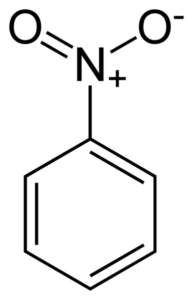 Flat struktur av nitrobenzenmolekylet. Elektronene til dobbeltbondyan -ringkoblingene har en tendens til å samhandle med nitro -ingen -gruppen2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Flat struktur av nitrobenzenmolekylet. Elektronene til dobbeltbondyan -ringkoblingene har en tendens til å samhandle med nitro -ingen -gruppen2. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Nitro -ingen gruppe2 har en tendens til å tiltrekke elektronene til benzen ringen C6H5-.
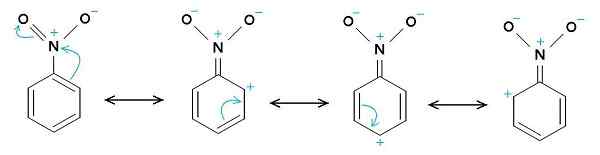 Nitrobenzenresonansstrukturer. Benzenringen har en tendens til å ha en positiv belastning, mens nitro -NO2 -gruppen har en tendens til å ha en negativ belastning. Den opprinnelige opplasteren var Samuele Madini på italiensk Wikipedia. [Offentlig domene]. Kilde: Wikimedia Commons.
Nitrobenzenresonansstrukturer. Benzenringen har en tendens til å ha en positiv belastning, mens nitro -NO2 -gruppen har en tendens til å ha en negativ belastning. Den opprinnelige opplasteren var Samuele Madini på italiensk Wikipedia. [Offentlig domene]. Kilde: Wikimedia Commons. Det er grunnen til at molekylet har en litt mer negativ side (hvor oksygenet til -nei er2) og en litt mer positiv side (benzenringen).
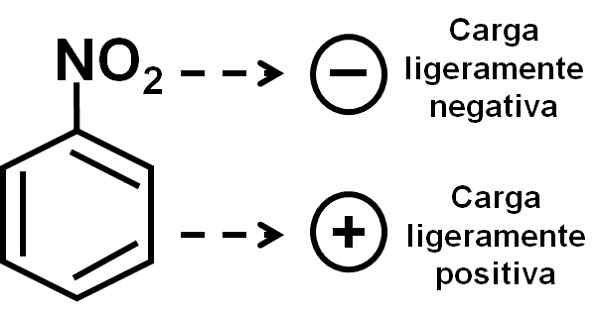 Oksygenet til nitro -gruppen har litt negativ belastning sammenlignet med benzen -ringen. Forfatter: Marilú Stea.
Oksygenet til nitro -gruppen har litt negativ belastning sammenlignet med benzen -ringen. Forfatter: Marilú Stea. Nomenklatur
- Nitrobenzen.
- Nitrobenze.
- Nitrobenzol.
- Olje eller essens av mirbano eller mirbana (nedlagt begrep).
Egenskaper
Fysisk tilstand
Fargerik fet væske til blekgul.
Molekylær vekt
123.11 g/mol.
Smeltepunkt
5,7 ºC.
Kokepunkt
211 ºC.
Det kan tjene deg: koboltklorid (COCL2 (: Struktur, nomenklatur, egenskaperFlashpoint
88 ºC (lukket koppmetode).
Selvordemperatur
480 ° C.
Tetthet
1 2037 g/cm3 ved 20 ºC.
Løselighet
Lite vannoppløselig: 0,19 g/100 g vann ved 20 ° C. Helt blandbar med alkohol, benzen og diety eter.
Kjemiske egenskaper
Nitrobencene er stabil opp til omtrent 450 ° C -temperatur der den begynner å dekomponere dannelse (i fravær av oksygen) nei, nei2, Benzen, bifenyl, anilin, Dibenzofurano og naftalen.
Blant de viktige reaksjonene av nitrobencen er reduksjon, nitrering, halogenering og sulfonering.
Nitrobenzen nitrering produserer opprinnelig meta-nitrobenzen og med lang reaksjonstid oppnås 1,3,5-nitobenzen.
Reagerer brom eller klor med nitrobenzen i nærvær av en passende katalysator oppnås 3-brom-nitrobenzen (meta-bromonitrobencene) eller 3-cllor-nitrobenzen (meta-kloronitrobenzen).
Et eksempel på reduksjon er at når man arbeider med tinn (SN) i saltsyre (HCl), oppnås meta-halogenonitobenzener ved meta-halogenoanyliner.
Sulfonasjonen av nitrobenzen utføres med røykende svovelsyre ved 70-80 ° C og produktet er meta-nitrobenzeulfonisk meta-nitrobenze. Dette kan reduseres med jern og HCl for å gi metanylsyre.
Dimmerformasjon
I en benzenløsning C6H6 Nitrobencenmolekyler er assosiert med hverandre og danner diameter eller molekyler par. I disse parene er en av molekylene i en omvendt posisjon med hensyn til den andre.
Dannelsen av nitrobenzendiametre med molekyler en i en omvendt posisjon med hensyn til den andre skyldes muligens at hver av dem har en litt mer positiv side og en motsatt side med litt mer negativ belastning.
I dimeren er siden med litt mer positiv belastning på en av molekylene muligens plassert nær den litt negative belastningen til det andre molekylet, fordi de motsatte belastningene er tiltrukket, og det skjer med de to andre sidene.
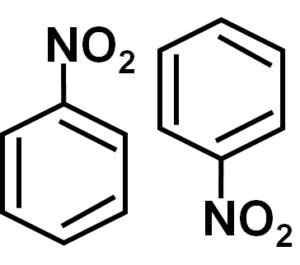 Nitrobencene tall, det vil si to molekyler som har en tendens til å være sammen i noen løsningsmidler. Forfatter: Marilú Stea.
Nitrobencene tall, det vil si to molekyler som har en tendens til å være sammen i noen løsningsmidler. Forfatter: Marilú Stea. Andre egenskaper
Den presenterer en lukt som ligner mandler eller å polere for sko. Ved å senke sin størkning av temperaturen i form av grønnaktig gule krystaller.
Å skaffe
Du får behandle benzen c6H6 Med en blanding av salpetersyre HNO3 og svovelsyre H2SW4. Prosessen kalles nitrering og innebærer dannelse av nitroniumionen ikke2+ Takket være tilstedeværelsen av svovelsyre H2SW4.
- Nitronio ion nr2+:
Hno3 + 2 h2SW4 ⇔ H3ENTEN+ + 2 HSO4- + NEI2+ (Nitronio ion)
- Nitronio ion angriper benzen:
Kan tjene deg: Systematisk feil: Hvordan beregne den, i kjemi, i fysikk, eksemplerC6H6 + NEI2+ → c6H6NEI2+
- Nitrobencene dannes:
C6H6NEI2+ + HSO4- → c6H5NEI2 + H2SW4
Oppsummert:
C6H6 + Hno3 → c6H5NEI2 + H2ENTEN
Benzennitreringsreaksjonen er veldig eksotermisk, det vil si at veldig varme genereres, så den er veldig farlig.
applikasjoner
Ved å få anilin og acetaminophen
Nitrobencene brukes hovedsakelig til å syntetisere anilin C6H5NH2, som er en mye brukt forbindelse for fremstilling av plantevernmidler, tannkjøtt, fargestoffer, eksplosiver og medisiner.
Å oppnå anilin oppstår ved å redusere nitrobenzen i surt medium i nærvær av jern eller tinn, som utføres i henhold til følgende trinn:
Nitrobenzen → Nitrosobenzen → Fenylhydroksylamin → Anilin
C6H5NEI2 → c6H5Nei → c6H5NHOH → c6H5NH2
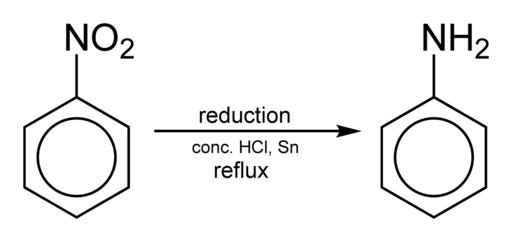 Nitrobencene reduksjon for å oppnå anilin. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons.
Nitrobencene reduksjon for å oppnå anilin. Benjah-BMM27 [Public Domain]. Kilde: Wikimedia Commons. Avhengig av forholdene, kan prosessen stoppes i et av mellomtrinnene for eksempel i fenylhydroksylamin. Med utgangspunkt i fenylhydroksylamin i et sterkt surt miljø, kan para-aminophenol fremstilles:
Fenylhdroksylamin → p-Aminofenol
C6H5NHOH → Hoc6H4NH2
Sistnevnte blir behandlet med eddiksanhydrid for å oppnå paracetamol (acetaminophen) en skånsom antipyretisk og myk smertestillende, det vil si en medisinering for å behandle feber og smerte og smerte.
 Noen ganger er det mulig å medisinere med acetaminophen til barn med feber. Acetaminophen er et nitrobenzenderivat. Forfatter: Augusto Ordonez. Kilde: Pixabay.
Noen ganger er det mulig å medisinere med acetaminophen til barn med feber. Acetaminophen er et nitrobenzenderivat. Forfatter: Augusto Ordonez. Kilde: Pixabay.  Acetaminophen -piller, et nitrobenzenderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe fra Ottawa, Canadaderivative Work: Anrie [CC av (https: // CreativeCommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons.
Acetaminophen -piller, et nitrobenzenderivat. Paracetamol_acetaminophen_500_mg_pils.JPG: Michelle Tribe fra Ottawa, Canadaderivative Work: Anrie [CC av (https: // CreativeCommons.Org/lisenser/av/3.0)]. Kilde: Wikimedia Commons. En annen måte å oppnå anilin er ved å redusere nitrobenzen med karbonmonoksid (CO) i vandig medium i nærvær av veldig små partikler (nanopartikler) av paladium (PD) som katalysator.
C6H5-NEI2 + 3 CO + H2O → c6H5-NH2 + 3 co2
Ved å oppnå andre kjemiske forbindelser
Nitobenzen er utgangspunktet for å oppnå et bredt utvalg av forbindelser som brukes som fargestoffer, plantevernmidler, medisiner og kosmetikk.
 Noen fargestoffer oppnås takket være nitrobenzen. Forfatter: Edith Lüthi. Kilde: Pixabay.
Noen fargestoffer oppnås takket være nitrobenzen. Forfatter: Edith Lüthi. Kilde: Pixabay. For eksempel tillater det å oppnå 1,3-dinitrobencene som ved klorering (tilsetning av klor) og reduksjon (eliminering av oksygenatomer) genererer 3-kloranylin. Dette brukes som mellomledd for plantevernmidler, fargestoffer og medisiner.
Nitobenzen ble brukt til å fremstille benkidin som er et fargestoff. I tillegg tjener nitrobenzen til å fremstille kinolin, azobenzen, metanylsyre, dyitobenzen, isocianate eller pyroxilin blant mange andre forbindelser.
I flere applikasjoner
Nitobenzen brukes eller brukes som:
Kan tjene deg: umettede hydrokarboner- Ekstraksjonsløsningsmiddel for rensing av smøreoljer som brukes i maskiner
- Løsningsmiddel for celluloseetere
- Blanding ingrediens til polske metaller
- I såper
- I blandinger for polske sko
- Spraymalingskonservator
- Gulvpoleringsblandingskomponent
- Almond Essence -erstatning
- I parfymeindustrien
- I produksjonen av syntetisk gummi
- Løsningsmiddel i forskjellige prosesser
 Nitobenzen er en del av noen blandinger til polske sko. D-Kuru [CC By-SA 3.0 AT (https: // creativecommons.Org/lisenser/by-SA/3.0/at/gjerning.i)]. Kilde: Wikimedia Commons.
Nitobenzen er en del av noen blandinger til polske sko. D-Kuru [CC By-SA 3.0 AT (https: // creativecommons.Org/lisenser/by-SA/3.0/at/gjerning.i)]. Kilde: Wikimedia Commons. Risiko
Nitobenzen er giftig ved innånding, inntak og absorpsjon gjennom huden.
Irriterer huden, øynene og luftveiene. Det kan forårsake en type anemi som kalles metemoglobinemi som består i å redusere evnen til røde blodlegemer til å frigjøre oksygen i vev og genererer tretthet.
I tillegg forårsaker nitrobencen dyspné, svimmelhet, opprørt syn, mangel på pust, kollaps og død. Det skader også leveren, milten, nyrene og sentralnervesystemet.
Det anslås at det kan være en mutagen og muligens forårsake kreft i mennesker, ettersom det har forårsaket det hos dyr.
I tillegg skal nitrobencen ikke kastes i miljøet. Dens toksisitet mot dyr, planter og mikroorganismer gjør det veldig skadelig for økosystemene.
Toksisitet mot mikroorganismer reduserer dens biologisk nedbrytbarhet.
Behandlinger for eliminering av miljøet
Forurensning av miljøet med nitrobencene kan oppstå gjennom avfallet av de forskjellige næringene som bruker det, for eksempel fargeleggingsindustrien eller eksplosivene.
Nitobenzen er en meget giftig og vanskelig å bryte ned under naturlige forhold, av denne grunn kan det forårsake alvorlig drikkeforurensning og såing av vanningsanlegg.
På grunn av sin høye stabilitet og toksisitet mot mikroorganismer, blir den ofte valgt som modell i kloakkbehandlingsstudier.
Ulike måter blir undersøkt for å eliminere forurenset vannnitrobenzen. En av dem er gjennom fotokatalytisk nedbrytning, det vil si ved bruk av sollys som en akselerator av nedbrytningsreaksjonen i nærvær av titandioksid i titan2.
 Med en sollysreaktor er det mulig å eliminere vannforurensning med nitrobencen. Mihai-Cosmin Pascariu [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Med en sollysreaktor er det mulig å eliminere vannforurensning med nitrobencen. Mihai-Cosmin Pascariu [CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Mikroelektrolysemetoder er også blitt testet med en jernkatalysator (tro) og kobber (Cu) i keramikk. Mikroelektrolyse lar nitrobenzen dekomponere gjennom en elektrisk strøm.
Referanser
- ELLER.S. National Library of Medicine. (2019). Nitrobenzen. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Morrison, r.T. og Boyd, r.N. (2002). Organisk kjemi. 6. utgave. Prentice-Hall.
- Moldoveanu, s.C. (2019). Pyrolyse av andre nitrogen-teller forbindelser. I pyrolyse av organiske molekyler (andre utgave). Gjenopprettet fra Scientedirect.com.
- Smith, s.W.G. et al. (1969). Aromatiske nitrering-nitroforbindelser. Elektrofile substitusjoner. I aromatisk kjemi. Gjenopprettet fra Scientedirect.com.
- WINDHOLZ, m. et al. (redaktører) (1983). Merck -indeksen. En enyclopedia av kjemikalier, medisiner og biologisk. Tiende utgave. Merck & co., Inc.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgellschaft MBH.
- Whang, t.-J. et al. (2012). UV-iradert fotokatalytisk nedbrytning av nitrobenzen av Titania-binding på kvartsrør. International Journal of PhotoEnergy, Volume 2012, Articles ID 681941. Hyndawi kom seg.com.
- Shikata, t. et al. (2014). Nitrobenzen anti-parallell dimerdannelse i ikke-polare løsningsmidler. AIP Advances 4, 067130 (2014). Gjenopprettet fra Doaj.org.
- Krogul-Obczak, a. et al. (2019). Reduksjon av nitrobenzen til anilin ved CO/H2Eller i vitnet om palladium nanopartikler. Catalysts 2019, 9, 404. MDPI kom seg.com.
- Yang, f. et al. (2019). Pilotskala produksjon, egenskaper og anvendelse av Fe/Cu katalytisk-keramisk-filler for nitrobenzenforbindelser avløpsbehandling. Katalysatorer 2019, 9, 11. MDPI kom seg.com.
- « Mekanisk fordelformel, ligninger, beregning og eksempler
- 110 evige kjærlighetsfraser for kjærester og ektemenn »

