Massenummer det det består av og hvordan du får det (med eksempler)
- 1986
- 116
- Markus Fredriksen
Han Massenummer o Massetall for et atom er summen av antall protoner og mengden kjerneneutroner. Disse partiklene er utpekt om hverandre med navnet til navnet Nukleoner, Derfor representerer massenummeret mengden av dem.
La antallet nøytroner til stede og z antall protoner, hvis vi kaller hvordan massenummeret, da:
A = n + z
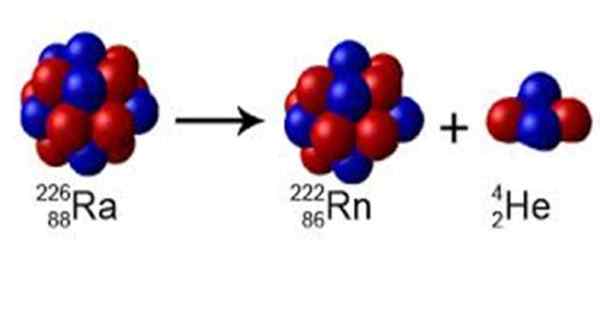
 Figur 1. Radioen har et massetall A = 226, den forfaller til radon med A = 222 og avgir en kjerne av helium på A = 4. Kilde: Wikimedia Commons. Perox [CC0] [TOC]
Figur 1. Radioen har et massetall A = 226, den forfaller til radon med A = 222 og avgir en kjerne av helium på A = 4. Kilde: Wikimedia Commons. Perox [CC0] [TOC]
Eksempler på massetall
Umiddelbart noen eksempler på massetall for kjente elementer:
Hydrogen
Det mest stabile og rikelig hydrogenatom er også det enkleste: 1 proton og et elektron. Siden hydrogenkjernen ikke har noen nøytroner, er det sant at a = z = 1.
Oksygen
En oksygenkjerne har 8 nøytroner og 8 protoner, derfor A = 16.
Karbon
Livet på jorden er basert på karbonkjemi, et lett atom med 6 protoner i kjernen pluss 6 nøytroner, som a = 6 + 6 = 12.
Uran
Dette tunge elementet enn de forrige, er kjent for sine radioaktive egenskaper. Urankjernen har 92 protoner og 146 nøytroner. Deretter er massenummeret ditt A = 92 + 146 = 238.
Hvordan få massenummeret?
Som sagt før, tilsvarer massenummer A av et element alltid summen av antall protoner og antall nøytroner som inneholder kjernen. Det er også et heltall, men ... er det noen regel når det gjelder forholdet mellom begge mengder?
La oss se: Alle elementene som er nevnt ovenfor er lette, bortsett fra uran. Hydrogenatomet er som sagt det enkleste. Den har ingen nøytroner, i det minste i sin mest tallrike versjon, og i oksygen og karbon er det like mange protoner og nøytroner.
Det kan tjene deg: Hva er utslippstørket? (Med eksempler)Det skjer også med andre lyselementer, for eksempel nitrogen, en annen veldig viktig gass for livet, som har 7 protoner og 7 nøytroner. Etter hvert som kjernen er mer kompleks og atomer blir tyngre, øker antallet nøytroner med en annen rytme.
I motsetning til lyselementer har uran, med 92 protoner, omtrent 1 ½ ganger den mengden i nøytroner: 1 ½ x 92 = 1.5 x 92 = 138.
Som du ser, er det ganske nær 146, mengden nøytroner den har.
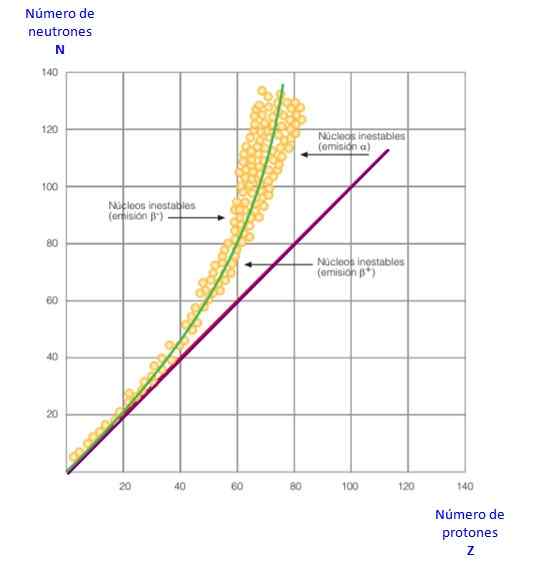 Figur 2. Stabilitetskurve. Kilde: f. Zapata.
Figur 2. Stabilitetskurve. Kilde: f. Zapata. Alt dette blir tydelig i kurven i figur 2. Det er en graf over n kontra z, kjent som kjernefysisk stabilitetskurve. Der kan det sees hvordan lette atomer har samme antall protoner som nøytron, og hvordan fra Z = 20 øker antallet nøytroner.
På denne måten blir det store atomet mer stabilt, siden overflødig nøytroner reduserer elektrostatisk frastøtning mellom protoner.
Notasjon for atomer
En veldig nyttig notasjon som raskt beskriver typen atom er som følger: symbolet på elementet og det respektive atom- og massetall er skrevet som vist nedenfor i dette skjemaet:
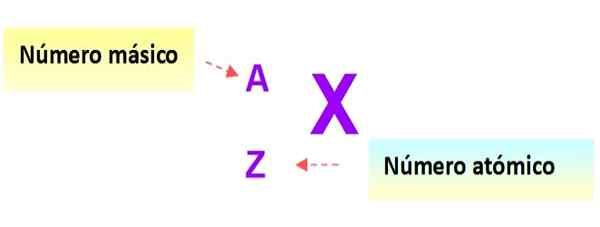 Figur 3. Atomnotasjon. Kilde: f. Zapata.
Figur 3. Atomnotasjon. Kilde: f. Zapata. I denne notasjonen ville atomene i de tidligere eksemplene være:

Noen ganger brukes en annen mer behagelig notasjon, der bare symbolet på elementet og massetallet for å betegne atomet brukes, og utelater atomnummeret. På denne måten 12 6C er skrevet ganske enkelt som karbon-12, 16 8Eller det ville være oksygen-16 og så for ethvert element.
Kan tjene deg: halvsirkel: Hvordan beregne omkretsen, området, centroid, øvelserIsotopene
Antall protoner i en kjerne bestemmer elementets natur. For eksempel er hvert atom hvis kjernen inneholder 29 protoner et kobberatom, hva som skjer.
Anta at et kobberatom mister et elektron uansett grunn, men det er fremdeles kobber. Imidlertid er det et ionisert atom.
Det er vanskeligere for en atomkjerne å vinne eller miste et proton, men i naturen kan det oppstå. For eksempel inne i stjernene er kontinuerlig dannet tyngre elementer fra lyselementer, siden stjernekjernen oppfører seg som en fusjonsreaktor.
Og akkurat her på jorden er det fenomenet med Radioaktiv oppløsning, der noen ustabile atomer utvider nukleoner og avgir energi, og transformerer seg til andre elementer.
Endelig er det muligheten for at et atom av et bestemt element har et annet massetall, i dette tilfellet er det en isotop.
Et godt eksempel er den velkjente karbon-14 eller radiokarbon, som brukes til å date arkeologiske objekter og som en biokjemisk sporstoff. Dette er det samme karbonet, med identiske kjemiske egenskaper, men med to ekstra nøytroner.
Karbon-14 er mindre rik enn karbon-12, den stabile isotopen, og er også radioaktiv. Dette betyr at det over tid forfaller ved å avgi energi og partikler til det blir et stabilt element, som i tilfelle er nitrogen.
Karbonisotoper
Karbon eksisterer i naturen som en blanding av flere isotoper, hvorav den mest tallrike er de nevnte 12 6C eller Carbon-12. Og i tillegg til karbon-14 er 1. 3 6C med et ekstra nøytron.
Kan tjene deg: vekslende strømkretser: Typer, applikasjoner, eksemplerDette er vanlig, for eksempel tinn, 10 stabile isotoper er kjent. På den annen side er en enkelt isotop kjent som beryllium og natrium.
Hver isotop, naturlig eller kunstig, har en annen transformasjonsrytme. På samme måte er det mulig å lage kunstige isotoper i laboratoriet, som vanligvis er ustabile og forfaller radioaktivt innen en veldig kort periode av andre fraksjoner, mens andre tar mye mer, like mye som jordens alder eller mer.
Naturlig karbonisotopbord
| Karbonisotoper | Atomnummer z | MASSNUMMER A | Overflod % |
|---|---|---|---|
| 12 6 C | 6 | 12 | 98.89 |
| 1. 3 6 C | 6 | 1. 3 | 1.elleve |
| 14 6 C | 6 | 14 | Spor |
Løste eksempler
- Eksempel 1
Hva er forskjellen mellom 1. 3 7 N og 14 7 N?
Svar
Begge er nitrogenatomer, siden atomnummeret deres er 7. Imidlertid har en av isotopene, som har en = 13, et mindre nøytron, mens 14 7 N er den mest tallrike isotopen.
- Eksempel 2
Hvor mange nøytroner er det i kjernen til et kvikksølvatom, betegnet som 201 80 Hg?
Svar
Siden a = 201 og z = 80, og også vite at:
A = z + n
N = a - z = 201 - 80 = 121
Og det konkluderes med at kvikksølvatomet har 121 nøytroner.
Referanser
- Connor, n. Hva er nukleon - Struktur av atomkjernen - Definisjon. Hentet fra: Periodisk-rabel.org.
- Knight, r. 2017. Fysikk for forskere og ingeniørfag: En strategitilnærming. Pearson.
- Sears, Zemansky. 2016. Universitetsfysikk med moderne fysikk. 14. Ed. Volum 2.
- Tippens, p. 2011. Fysikk: konsepter og applikasjoner. 7. utgave. McGraw Hill.
- Wikipedia. Massenummer. Hentet fra: i.Wikipedia.org.
- « Magnesiumnitrat (Mg (NO3) 2) Struktur, egenskaper, bruk
- Coplanares peker ligning, eksempel og løste øvelser »

