Tilsvarende vekt
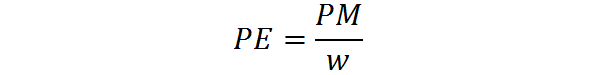
- 2814
- 705
- Mathias Aas
Hva er den tilsvarende vekten?
Han tilsvarende vekt Det er vekten eller massen av et ekvivalent av stoffet. Det vil si at det er vekten eller massen til et stoff som kjemisk tilsvarer 1 mol av et annet stoff av samme type som brukes som et referansemønster og regnes som normalt.
Det normale stoffet tatt som referanse avhenger av hvilken type kjemisk reaksjon som er involvert og rollen som forbindelsen spiller i den reaksjonen. Normale forbindelser reagerer alltid med hverandre med støkiometri 1: 1.
For eksempel, hvis vi snakker om en syre/basereaksjon, vil den ekvivalente vekten av en syre være vekten av nevnte forbindelse som tilsvarer 1 mol en normal syre, som er en som har en enkelt ioniserbar proton.
Før det ble kjent at saken ble dannet av atomer og molekyler, var det allerede blitt etablert en rekke lover som bestemte masseforholdet (eller vekt) mellom reagensene og produktene fra en kjemisk reaksjon allerede.
Disse lovene dannet basene for støkiometriske beregninger under begynnelsen av kjemi som vitenskap.
Det tilsvarende vektkonseptet er relatert til dette tidlige stadiet av kjemiutvikling. Deretter vil vi diskutere hvordan det beregnes, hva det er for og noen vanlige eksempler på beregningen din.
Formel og tilsvarende vektenheter
Den ekvivalente vekten beregnes ut fra molekylvekten til ett stoff ved hjelp av følgende formel:
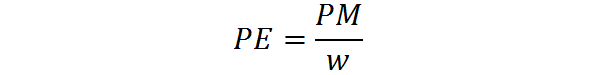
Der PE er den ekvivalente vekten, er PM molekylvekten eller molmassen til stoffet, og W representerer antall ekvivalenter per mol.
Sistnevnte består alltid av et heltall likt eller større enn 1. Det representerer antall molekyler av et "normalt" reagens som hvert stoffmolekyl er ekvivalent. Derfor avhenger det av hvilken type reagens det gjelder og hvilken type kjemisk reaksjon involvert.
Kan tjene deg: dihydroxyacetone: struktur, egenskaper, innhenting, brukDet kan også beregnes ut fra deigen, m og antall tilsvarende:
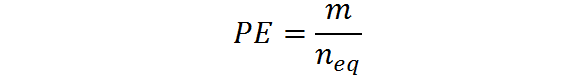
Tilsvarende vektenheter
Som det fremgår av den forrige formelen, uttrykkes den tilsvarende vekten i masseenheter (vanligvis gram) på antall tilsvarende. Det vil si at enhetene er g/ekv.
Verdien av W I den første forrige formelen kommer det til uttrykk i ekvivalente enheter på mol (ekv/mol), mens molmassen er uttrykt i gram over mol (g/mol).
Hva er den tilsvarende vekten for?
Hovedverktøyet for den tilsvarende vekten er at den forenkler de støkiometriske beregningene. Den tilsvarende vekten av et stoff tilsvarer et annet stoff av samme type og for samme type kjemisk reaksjon. Faktisk derfra får han navnet sitt.
Dette lar oss utføre støkiometriske beregninger på en veldig enkel måte og uten behov for å skrive og balansere kjemiske ligninger.
Hvordan beregnes den tilsvarende vekten?
Som vi så før, beregnes den tilsvarende vekten ut fra molekylvekten og antall ekvivalenter per mol eller w.
Beregning av molekylvekt
Molekylvekten til et stoff bestemmes ved å tilsette atomvekten til alle atomene som utgjør det. Disse atomvektene finnes i det periodiske bordet.
Bestemmelse av W
Verdien av W For et stoff avhenger det av hvilken type reaksjon det er involvert. Det vil si at det avhenger av hvilken type reagens det gjelder. For hver type stoff er det en annen måte å bestemme W.
Tabellen nedenfor viser hvordan den bestemmes W For forskjellige tilfeller.
Det kan tjene deg: kalsiumhypokloritt (CA (CLO) 2)| Type reagens | Verdien av W |
| Syrer | Antall ioniserbare hydrogener for hvert syremolekyl. |
| Baser | Antall protoner som kan fange eller nøytralisere hvert basismolekyl. |
| Oksidasjonsmidler | Antall elektroner som fanger opp hver mol oksidasjonsmiddel i semi -retaksjon av reduksjon. |
| Reduserende midler | Antall elektroner som frigjøres hver mol reduksjonsmiddel i oksidasjon halvtraksjon. |
| Du går ut | Totalt antall positive eller negative ladninger som genereres når et av saltet. |
| Nøytrale stoffer | 1 |
Det skal bemerkes at hvis et stoff kan delta i mer enn en type kjemisk reaksjon, kan det ha mer enn en verdi av W Og derfor mer enn en tilsvarende vekt.
Viktighet og anvendelser av den tilsvarende vekten
Den ekvivalente vekten brukes til å beregne antall ekvivalenter i et kjemikalie. Dette antallet ekvivalenter er alltid lik antall ekvivalenter til et annet stoff som det reagerer.
Dette brukes hovedsakelig på to forskjellige områder:
I analytisk kjemi
Ekvivalenter brukes ofte for å lette støkiometriske beregninger i analytisk kjemi. Dette gjelder spesielt når det gjelder volumetrisk og gravimetrisk analyse.
Kunnskapen om volumet av graden ved ekvivalenspunktet og konsentrasjonen av titulæret, så vel som den tilsvarende vekten av de berettigede, tillater enkelt å beregne massen til analytten som er til stede i en prøve.
I elektrolyse
I feltet elektrolyse representerer den ekvivalente vekten vekten av ett metall eller annet stoff som kan oppstå når 96.500 c lasting gjennom elektrolytisk celle. Dette letter støkiometriske og økonomiske beregninger av elektrolyseprosessen.
Kan tjene deg: Merkur Oxide (HG2O)Eksempler på den tilsvarende vektberegningen
Kalsium
Atomvekten av kalsium er 40 og dette metallet danner kationer med Valencia +2, så dens tilsvarende vekt er 40/2 = 20 g/ekv.
Svovelsyre (h2SW4)
Molekylvekten til denne forbindelsen er 98 og er en diprotsyre, så W = 2. Derfor er den tilsvarende vekten PE: 98/2 = 49 g/ekv.
Aluminiumhydroksyd (AL (OH)3)
Aluminiumhydroksyd (PM = 78) er en amfoterforbindelse som kan fungere som syre og som en base.
Hvis du fungerer som en base ved å frigjøre de tre hydroksider, så W = 3, Så PE: 78/3 = 26 g/ekv. På den annen side, når den fungerer som en syre, fanger den et vannmolekyl og frigjør et proton, så i dette tilfellet, W = 1 og PE = 78 g/ekv.
Kalsiumfosfat (CA3(Po4)2)
Kalsiumfosfat er et salt som, når de dissosierer, produserer 3 CA -ioner2+ og 2 ioner PO43-.
I alle fall er antall belastninger med samme tegn som hver kalsiumfosfatenhet produserer 6, så W = 6 og PE = 310/6 = 51,67 g/ekv.
Referanser
- Universal Encyclopedia (S. F.). Tilsvarende vekt. Hentet fra Encyclopedia_Universal.ES-akademisk.com.
- Kjemi, uorganisk kjemi (s. F.). Tilsvarende vekt. Hentet fra Fullquimica.com.
- Kjemi.Det er (S. F.). Tilsvarende. Hentet fra kjemi.er.
- Spiegato (2021). Hva er den tilsvarende vekten? Hentet fra Spiegato.com.

