Oktettregel

- 2249
- 101
- Daniel Skuterud
 Representasjon av et karbondioksidmolekyl som viser samsvar med oktettregelen
Representasjon av et karbondioksidmolekyl som viser samsvar med oktettregelen Hva er oktettregelen?
De Oktettregel Det er en praktisk regel som forklarer dannelsen av den kjemiske bindingen til de representative elementene basert på den elektroniske konfigurasjonen av dets valenslag.
I følge denne regelen kombineres atomene med hverandre på en slik måte at hvert atom er omgitt av åtte elektroner i valenslaget (derav ordet oktett).
Denne regelen ble publisert samtidig i 1.916 Både Gilbert Lewis og Walther Kossel. Det gjenspeiler observasjonen at edle gasser er veldig stabile og alt, med unntak av helium, er de preget av å ha valenslaget sitt med 8 elektroner.
Teorien slår fast at atomer deler eller utveksler elektroner ved å danne kjemiske bindinger, for å skaffe seg denne fulle -Lagers elektroniske konfigurasjonen.
Oktettregelen og Lewis -strukturer
Octet -regelen og Lewis -strukturene er nært beslektede. Dette er fordi oktettregelen er en av basene for å forstå dannelsen av den kjemiske bindingen, så den tillater å forutsi i de fleste tilfeller, Lewis -strukturen til kjemikalier.
I denne forstand er et av de essensielle trinnene for å trekke en Lewis -struktur, etter å ha plassert enkle koblinger mellom alle atomene som danner molekylet, å fordele de gjenværende valenselektronene blant de mest elektronegative atomer for å fullføre oktettene sine.
I tilfeller der oktetter er uten å fylle, dannes doble eller trippelbindinger, og leter alltid etter oktettregelen for så mange atomer som mulig. Så denne empiriske regelen er avgjørende for bygging av Lewis -strukturer.
Det kan tjene deg: Silver Yoduro (AGI): Struktur, egenskaper, innhenting, brukEksempler på samsvar med oktettregelen
Octet -regelen brukes hovedsakelig på de representative elementene, det vil si for S- og P -blokkene i det periodiske tabellen. Denne regelen brukes konsekvent på forbindelser som inneholder karbon, nitrogen, oksygen og halogener, og med noen unntak fra de andre elementene i P -blokken. De fleste overgangsmetaller overholder imidlertid ikke.
Noen eksempler på forbindelser der oktettregelen er oppfylt for alle atomer er:
Karbondioksid (CO2)
Som det kan sees i Lewis -strukturen til karbondioksidet presentert nedenfor, overholder både det sentrale karbonet og begge oksygenatomer oktettregelen.
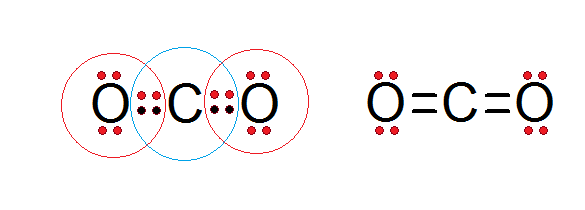
Karbon er omgitt av sine 4 valenselektroner, pluss to elektroner fra hvert oksygen, som bidrar til å danne dobbeltbindinger C = O, mens hvert oksygen er omgitt av 6 egne elektroner pluss et par fra karbon.
Neopentano (ca5H12)
I de aller fleste organiske forbindelser oppfyller alle atomer oktettregelen (bortsett fra hydrogen som er omgitt av bare 2 elektroner). Dette inkluderer alkaner som Neopentano eller 2,2-dimetylpropan:
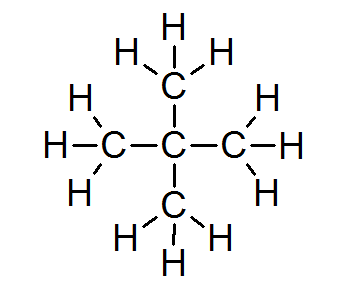
I dette tilfellet kan det også sees at hvert karbonatom deler sine fire elektroner med 4 nærliggende atomer, som hver gir en av elektronene sine for å danne de 4 enkle kovalente bindinger som holder sammen.
Av denne grunn er hvert karbonatom omgitt av 8 valenselektroner, i samsvar med oktettregelen.
Kan tjene deg: aktiveringsenergiKarbonmonoksid (CO)
Karbonmonoksid er en annen molekylær forbindelse der oksygen og karbon deler elektroner som danner en kovalent binding for å tilfredsstille oktettregelen.
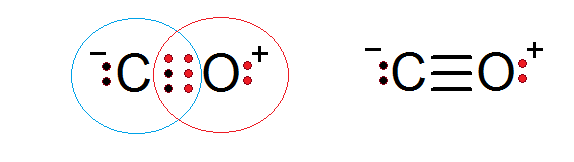
I dette tilfellet gir karbon to elektroner og oksygen 4 for å fullføre de 6 elektronene som kreves for å danne den trippel kovalente bindingen som forener dem. Hvert av de to atomene har ytterligere elektroner uten å dele som fullfører hver oktett.
Nitratanion (nei3-)
Også i tilfelle av ioner er oktettregelen oppfylt. Nitrationet har et sentralt nitrogenatom omgitt av 3 oksygenatomer.
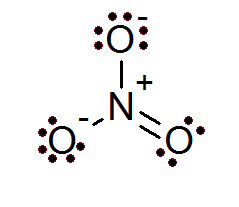
Som det fremgår av dette tilfellet, har alle atomer sin fulle oktett, to av oksygenene har en negativ formell belastning mens nitrogen har en positiv formell belastning, noe som resulterer i nettlasten på -1 nitration.
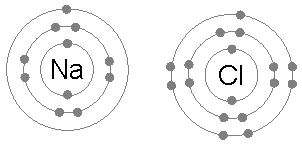
Natriumklorid (NaCl)
Utveksling av elektroner til å danne ioniske forbindelser er også et vanlig eksempel på anvendelsen av oktettregelen.
Når natriumklorid dannes fra klor og natrium, starter det fra to atomer som ikke overholder oktettregelen, siden natrium på et elektron og klor mangler en for å fullføre oktetten.
Deretter gir natriumet elektronet sitt til klor, og etterlater kationen omgitt av 8 elektroner og på sin side fullfører oktetten til klor ved å danne kloridion.
 Unntak fra oktettregelen
Unntak fra oktettregelen
Akkurat som det er et stort antall forbindelser der alle atomer oppfyller oktettregelen, er det også flere eksempler på atomer som ikke overholder det.
Det kan tjene deg: Potensielle z: Verdier, koagulasjonsgrader, bestemmelse, brukNoen er omgitt av mindre enn 8 elektroner, så de er Dårlig elektronarter, mens andre er omgitt av mer enn åtte elektroner, i så fall sies det at den har en utvidet oktett eller kalles Hypervalent atom.
Eksempler på dårlige elektronarter
Bordean (BH3)
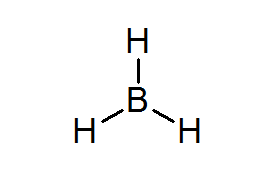
Denne forbindelsen er et typisk eksempel på en dårlig type elektroner. Verken bor eller de omkringliggende hydrogenene har nok elektroner til å tilfredsstille oktettregelen i det sentrale atomet. Dette fører til at bor får et par elektroner fra et annet atom i et annet molekyl, og gjør Bordeal til en syre fra Lewis.
Aluminium Triclurur (ALCL3)
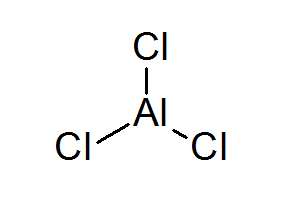
ALCL3 Det er et annet eksempel på en Lewis -syre som skylder sin kjemiske oppførsel som den ikke oppfyller oktettregelen.
Eksempler på hypervaluerende arter
Svovel heksafluoruro (SF6)
Et typisk eksempel på en utvidet oktett er SF6, som vanligvis er representert som en sentral svovel med 6 enkle kovalente bindinger med fluoratomer. I dette tilfellet er svovel omgitt av 12 valenselektroner i stedet for 8, så det bryter oktettregelen.
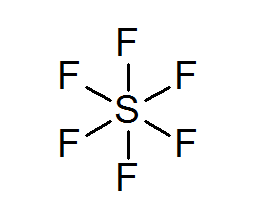
Til tross for dette er det blitt foreslått modeller der svovel faktisk er knyttet til kovalente bindinger til 4 fluorer samtidig, mens de to andre er med de to, danner ioniske bindinger. I så fall ville det oppfylle oktettregelen.
Fosforpentaklorid (PCL5)
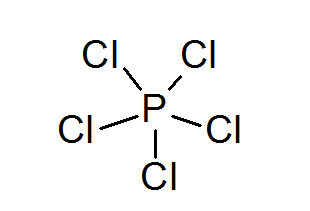
Som i tilfelle av svovel, kan fosfor også danne forbindelser med utvidede oktetter, i dette tilfellet omgitt av 10 elektroner.

