Isokorisk prosess
- 1788
- 551
- Magnus Sander Berntsen
Hva er en isokorisk prosess?
EN Isokorisk prosess Det er enhver termodynamisk prosess der volumet forblir konstant. Disse prosessene får ofte også navnet til isometrisk eller isovolumetrisk. Generelt kan en termodynamisk prosess oppstå ved konstant trykk og kalles da isobarisk.
Når det oppstår ved konstant temperatur, sies det i så fall at det er en isotermisk prosess. Hvis det ikke er noen varmeutveksling mellom systemet og miljøet, er det snakk om adiabatisk. På den annen side, når det er et konstant volum, kalles prosessen som genereres isokorisk.

Når det.
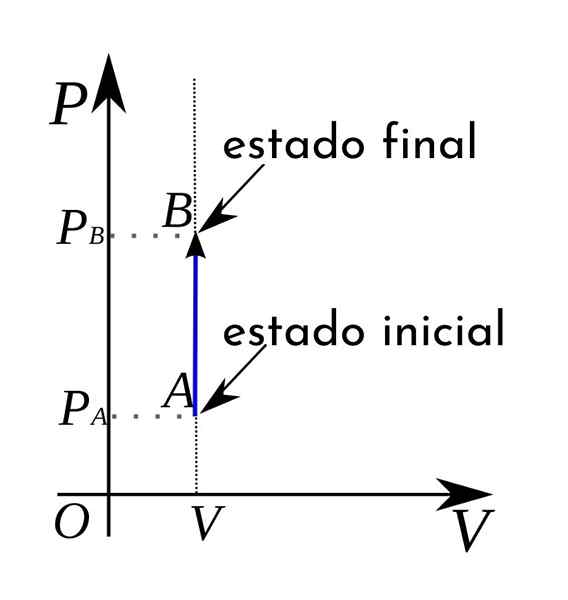
I tillegg er de isokoriske prosessene i et termodynamisk trykkvolumskjema representert i form av en vertikal rett linje.
Formler og beregning
Det første prinsippet om termodynamikk
I termodynamikk beregnes arbeidet ut fra følgende uttrykk:
W = p ∙ ∆ v
I dette uttrykket w er arbeidet målt i joules, p trykket målt i Newton per kvadratmeter, og ∆ V er variasjonen eller økningen i volum målt i kubikkmeter.
På samme måte er det kjent som det første prinsippet om termodynamikk at:
∆ u = q - w
I denne formelen w er det arbeidet som er utført av systemet eller på systemet, som er varmen mottatt eller utstedt av systemet, og ∆ u Det er den interne energisvariasjonen i systemet. Ved denne anledningen måles de tre størrelsene i joules.
Siden i en isokorisk prosess er arbeidet null, viser det seg at det er oppfylt det:
Kan tjene deg: Neptune (planet)∆ u = qV (siden, ∆ v = 0, og derfor w = 0)
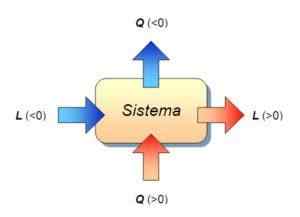
Det vil si at den interne energisiasjonen til systemet bare skyldes utveksling av varme mellom systemet og miljøet. I dette tilfellet kalles den overførte varmen varme til konstant volum.
 Varmekapasitet ved konstant volum
Varmekapasitet ved konstant volum
Varmekapasiteten til et legeme eller et system er resultatet av å dele mengden energi i form av varme overført til et legeme eller et system i en gitt prosess og temperaturendringen opplever av den samme.
Når prosessen utføres ved konstant volum, snakkes det om varmekapasitet til konstant volum og betegnes med Cv (Molar varmekapasitet).
Det vil bli oppfylt i den saken:
Qv = N ∙ cv ∙ ∆t
I denne situasjonen er n antall føflekker, cv Det er den nevnte varmekapasiteten molar til konstant volum og ∆T er temperaturøkningen som kroppen eller systemet eller systemet opplever.
Daglige eksempler på isokoriske prosesser
Det er lett å forestille seg en isokorisk prosess, det er bare nødvendig å tenke på en prosess som oppstår ved konstant volum; det vil si der beholderen som inneholder material- eller materialsystemet ikke endrer volum.
Et eksempel kan være tilfelle (ideell) låst i en lukket beholder hvis volum ikke kan endres på noen måte som leveres varme. Anta at saken om en gass låst i en flaske.
Ved å overføre varme til gass, som allerede forklart, vil det ende opp med å resultere i en økning eller økning i dens indre energi.
Den omvendte prosessen vil være den for en gass innelukket i en beholder hvis volum ikke kan endres. Hvis gassen avkjøles og gir varme til miljøet, vil gasstrykket og verdien av den indre energien til gassen avta reduseres.
Det kan tjene deg: Diskret variabel: Karakteristikker og eksemplerDen ideelle syklusen Otto
Otto -syklusen er et ideelt tilfelle av syklusen som brukes av bensinmaskiner. Imidlertid var den første bruken i maskinene som brukte naturgass eller annet drivstoff i gassform.
I alle fall er Ottos ideelle syklus et interessant eksempel på den isokoriske prosessen. Det oppstår når det i en forbrenningsbil, forbrenningen av bensin- og luftblandingen foregår øyeblikkelig.
I så fall finner en økning i temperaturen og gasstrykket i sylinderen sted, og forblir konstant volum.
Praktiske eksempler
Første eksempel
Gitt en gass (ideell) låst i en sylinder utstyrt med et stempel, indikerer om følgende tilfeller er eksempler på isokoriske prosesser.
- Et 500 J -arbeid med bensin er ferdig.
I dette tilfellet ville det ikke være en isokorisk prosess fordi det å gjøre en jobb på bensin er nødvendig å komprimere den, og derfor endre volumet.
- Gassen utvides horisontalt stemplet.
Igjen ville det ikke være en isokorisk prosess, siden gassutvidelse innebærer en variasjon i volumet.
- Sylinderstempelet er fikset slik at gass ikke kan flyttes og gassen avkjøles.
Ved denne anledningen ville det være en isokorisk prosess, siden det ikke ville være noen volumvariasjon.
Andre eksempel
Bestem variasjonen av indre energi som vil oppleve en gass som er inneholdt i en beholder med et volum på 10 l Cv = 2.5 ·R (å være R = 8.31 J/mol · K).
Det kan tjene deg: Graff Van Generator: Fester, hvordan det fungerer, applikasjonerSiden det er en konstant volumprosess, vil indre energivariasjon bare oppstå som følge av varmen som leveres til gass. Dette bestemmes med følgende formel:
Qv = N ∙ cv ∙ ∆t
For å beregne varmen som leveres, er det først nødvendig å beregne molens gass som finnes i beholderen. For dette er det nødvendig å ty til ligningen av ideelle gasser:
P ∙ V = N ∙ R ∙ T
I denne ligningen n er antall føflekker, r er en konstant hvis verdi er 8,31 j/mol · k, t er temperaturen, p er trykket som gassen målt i atmosfærer og t blir utsatt og t er temperaturen målt i Kelvin.
Det blir ryddet og oppnådd:
n = r ∙ t/ (p ∙ v) = 0, 39 føflekker
Så det:
∆ u = qV = N ∙ cv ∙ ∆T = 0,39 ∙ 2,5 ∙ 8,31 ∙ 26 = 210,65 J

