Lovet (PM) struktur, egenskaper, innhenting, bruk

- 3815
- 1026
- Dr. Andreas Hopland
Han lovet Det er et kjemisk element som tilhører Lantanids -klassen. Det er identifisert med PM -symbolet og atomnummeret er 61. Det er et radioaktivt metallisk fast stoff og er det mest ustabile elementet i de første 84 elementene i det periodiske bordet.
Dette elementet finnes naturlig i veldig lave konsentrasjoner (ca. 4 x 10-femten gram per kg) i en type uraninitt, som er et uranmineral, der det lovede er til stede på grunn av den spontane fisjonen av uran-238.
 Symbol, atomnummer og atommasse av løftet. Kilde: ME/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5). Kilde: Wikimedia Commons.
Symbol, atomnummer og atommasse av løftet. Kilde: ME/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/2.5). Kilde: Wikimedia Commons. Til tross for mangelen i jordskorpen, er det blitt oppdaget i spekteret av HR465 -stjernen til Andromeda -stjernebildet, på hvis overflate det er anslått at den nylig har dannet seg, siden ingen PM -isotop har en lengre halvliv på 17, 17, 7 år.
Det var nyttig i gjenstander som skinner i mørket, men på grunn av deres radioaktivitet sluttet det å bruke i disse. Det brukes til å måle materialtykkelser og kjernekraftbatterier.
[TOC]
Oppdagelse
Eksistensen av Prometio ble mistenkt i 1902 av kjemikeren Czech Bohuslav Brauner. Senere, i 1914, fant den engelske fysikeren Henry Moseley i studiene at et element manglet mellom Neodymium og Samarium.
Deretter, selv om flere grupper av forskere (italienere i 1924, kunngjorde amerikanere i 1926 og 1938) deres oppdagelse, og vanskeligheten med å skille den fra andre elementer og reprodusere opplevelsene som ikke var i stand til å ta fortjeneste.
 Jacob a. Marinsky. Ornl / pub domene. Kilde: Wikimedia Commons.
Jacob a. Marinsky. Ornl / pub domene. Kilde: Wikimedia Commons. Til slutt, i 1944, forskerne Marinsky J.TIL., Glendenin L.OG. og Coryell c.D. De testet sin tilstedeværelse og isolerte den fra med -produktene av uran fisjon i atomreaktoren til Clinton Laboratories i Oak Ridge i Tennessee, USA.
 Larry e. Glendenin. Ornl / pub domene. Kilde: Wikimedia Commons.
Larry e. Glendenin. Ornl / pub domene. Kilde: Wikimedia Commons. De hevdet imidlertid ikke prioriteten i oppdagelsen før i 1946 for å være dedikert fullt ut til hemmelige undersøkelser relatert til forsvarsaktiviteter under andre verdenskrig.
Navnoppgave
Selv om forskerne hadde foreslått å kalle ham "Clintonium" til ære for laboratoriene der de jobbet, overbeviste Coryells kone dem om å kalle ham "lovet" som et minne om den greske Titan Prometheus eller Prometheus.
 Charles d. Coryell. Forfatter av bildet: Christian a. Coryell/GFDL (http: // www.gnu.Org/copyleft/fdl.html). Kilde: Wikimedia Commons.
Charles d. Coryell. Forfatter av bildet: Christian a. Coryell/GFDL (http: // www.gnu.Org/copyleft/fdl.html). Kilde: Wikimedia Commons. I følge noen tolkninger av gresk mytologi stjal Prometheus gudene ild for å gi den til menneskeheten, så han ble grusomt straffet i all evighet. Andre legender sier at det ga mennesker med matematikk, vitenskap, landbruk og medisin, og til og med skapte mennesket.
Det kan tjene deg: Clausius-Clapeyron-ligning: Hva er det for, eksempler, øvelser Prometheus representasjon av en tysk billedhugger. © El Grafo / CC-by-SA-4.0 / pub domene. Kilde: Wikimedia Commons.
Prometheus representasjon av en tysk billedhugger. © El Grafo / CC-by-SA-4.0 / pub domene. Kilde: Wikimedia Commons. Denne tvilen om hva som var Prometheus sitt bidrag til menneskeheten ligner usikkerhet om hvem som oppdaget elementet. På den annen side, ifølge Coryells kone, var navnet berettiget da forskere hadde "stjålet gudenes ild" når de oppdaget det under Atomic Bomb Secret -programmet.
Elektronisk struktur
Den elektroniske konfigurasjonen av dette elementet er:
1s2; 2s2 2p6; 3s2 3p6 3d10; 4s2 4p6 4d10; 5s2 5p6; 4F5 6s2;
som også kan uttrykkes som:
[Xe] 4F5 6s2.
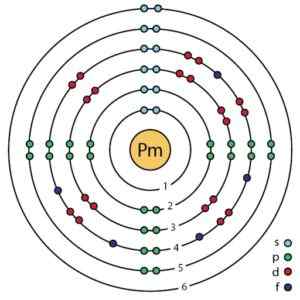 Prometio elektronisk struktur i henhold til Bohrs forbedrede atommodell. Ahazard.ScienceWriter/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Prometio elektronisk struktur i henhold til Bohrs forbedrede atommodell. Ahazard.ScienceWriter/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. Nomenklatur
- Lovet, PM -symbolet.
- Prometio-147, PM-147 eller 147PM: Isotope del Prometio med atommasse 147.
Egenskapene til prometio
Fysisk tilstand
SLILLED METALLISK SOLID, sekskantede krystaller.
Atommasse
144.91
Smeltepunkt
1042 ºC
Kokepunkt
3000 ºC
Tetthet
7.26 g/cm3
Kjemiske egenskaper
Det tilhører familien til lantanidene, lantanoider eller "sjeldne jordarter", kalt det fordi de i jordskorpen alltid er i form av oksydene sine. Er en del av perioden 6 i den periodiske tabellen til elementene.
I følge kilder som ble konsultert, reagerer statsministeren, som de andre lantanidene, direkte med vannet, sakte kaldt, raskt når du oppvarmer, frigjør hydrogen (h2). Det mørkner seg raskt i luft og brenner lett å produsere oksydet.
Mer enn 30 prometioforbindelser er blitt fremstilt, og de fleste har en type farge. Oksidasjonsstatusen i disse forbindelsene er +3. Danner ikke tetravalente kationer.
Dannelse av noen forbindelser
Oppløsning av det i saltsyre (HCl) det lovede former PMCL3 som er gult og vannløselig. I salpetersyre (HNO3) PM genereres (nei3)3 Det er rosa og også løselig i vann.
Hvis en løsning som inneholder PM -ioner3+ er alkalisert med NH3, Det vil si at pH økes, hydroksydet utfeller (PM (OH)3) lysebrun.
Kan tjene deg: ionisk lenke: egenskaper, hvordan det dannes og eksemplerPM sulfat2(SW4)3 Den er litt løselig i vann. Hvis Prometios oksalat blir oppvarmet, blir det PM -oksydet2ENTEN3 hvit eller lavendel.
Radioaktiv utslipp
Avgir beta -stråling i form av elektroner som etterlater kjernen til atomene deres. Når du utsteder det, blir det samariumelementet (SM). På den annen side kan det bli neodym (ND) ved å eliminere en kjernepositron og fangst av et elektron i samme. Statsministeren avgir ikke gammastråler.
Isotoper
Så langt er 14 isotoper av Prometio kjent, med atommasser som varierer fra 134 til 155. Alle er ustabile (radioaktive), som skiller det fra andre lantanider.
Prometio-147 er den med det største verktøyet og har en halveringstid på 2,6 år.
Isotop med større halvliv
Den lengste halveringstiden isotopen er prometio-145 med 17,7 år, som forfaller ved elektronisk fangst, som består av et atomelektron er kombinert med et proton og danner et nøytron og en nøytrino.
Imidlertid er det den eneste isotopen av PM som også kan lide alfa -oppløsning (utslipp av 2 nøytroner). Dette er fordi det har 84 nøytroner og utstedelse av 2 av dem gjør det til prometio-141 med 82 nøytroner, som er en stabil konfigurasjon av kjernen. Men dette er en type forfall som forekommer veldig lite.
Nåværende innhenting
I 1963 ble omtrent 10 gram prometio utarbeidet ved bruk av ionebytte kromatografimetoder i atomreaktor drivstoffavfall. I dag er det fortsatt å komme seg på denne måten som salter av 147P.m3+.
I følge visse kilder ble det også utarbeidet i disse årene gjennom fluorreduksjon (PMF3) Med litium damp (li). Det er også utarbeidet ved kloridreduksjon (PMCL3) Med kalsium (CA) ved høye temperaturer.
Det kan også fås fra neodym-146. Denne isotopen blir utsatt for bombing med nøytroner slik at hvert atom fanger et nøytron og blir neodym-147. Sistnevnte tar omtrent 11 dager som lider beta-oppløsning, og transformerer dermed i prometio-147.
applikasjoner
Isotopen 147 (147PM) er den som har blitt brukt mest, og er den eneste som kan bli funnet kommersielt. Avgir ikke gammastråler og tilføres i form av oksid eller klorid. Deres transport og manipulering krever imidlertid beskyttelse mot stråling.
Det kan tjene deg: Hydrolyse: Hva er det og eksempler på reaksjonerDen hadde noen bruksområder som i dag ikke lenger har, fordi det for øyeblikket brukes i spesielle applikasjoner.
I batterier
Prometio-147 brukes i langsiktige atombatterier. I dette tilfellet er små deler av statsministeren plassert i matrisen til en halvleder for å konvertere beta -utslipp til elektrisitet.
Denne typen kjernefysiske energibatterier kan gi energi i omtrent 5 år og har blitt brukt i alle typer enheter, fra missiler til pacemakere, som er enheter plassert hos pasienter med hjerteproblemer.
 Pacemakers kan ha langvarige batterier basert på prometio. Forfatter: 242799. Kilde: Pixabay.
Pacemakers kan ha langvarige batterier basert på prometio. Forfatter: 242799. Kilde: Pixabay. I medisinske applikasjoner
I følge visse kilder brukes Prometios oksid i medisin som strålingskilde.
I bransjen
Det har blitt brukt til å måle tykkelsen på noen materialer, som gjøres ved å måle beta -strålingen som passerer gjennom prøvene.
Potensielle applikasjoner
Den kan brukes som en transportabel røntgenkilde, men tilsynelatende er denne applikasjonen ennå ikke kommersielt utviklet.
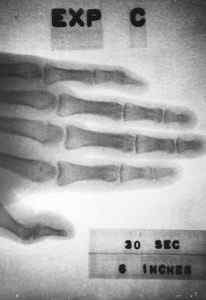 Røntgenbilde oppnådd i 1963 med en liten enhet (ca. 10 cm x 5 cm x 1 cm) som inneholder prometio-147. Energi.GOV / PUB -domene. Kilde: Wikimedia Commons.
Røntgenbilde oppnådd i 1963 med en liten enhet (ca. 10 cm x 5 cm x 1 cm) som inneholder prometio-147. Energi.GOV / PUB -domene. Kilde: Wikimedia Commons. Det vil også tjene til å gi energi til rom og satellittprober eller å lage enheter som tillater kommunikasjon med ubåter.
Avbrudd bruk i lyssignaler
Opprinnelig ble prometio-147 brukt til å erstatte radioelementet i de lysende skivene, siden det ble lært at radioen var for farlig. For dette var PMCL blandet3 Med luminoforer, som skinner fra grønnaktig gul til blå når strålingen av de lovede (beta -partiklene) påvirker dem.
 Noen titalls år siden kunne nålene på armbåndklokkene sees i mørket på grunn av lysstyrken forårsaket av radioaktiviteten til prometio. Forfatter: Monacocannes. Kilde: Pixabay.
Noen titalls år siden kunne nålene på armbåndklokkene sees i mørket på grunn av lysstyrken forårsaket av radioaktiviteten til prometio. Forfatter: Monacocannes. Kilde: Pixabay. Denne egenskapen ble brukt i armbåndsklokker eller ringer for å skinne i mørket. Også i tenningsknappen til noen lysstoffrør. I tillegg skadet det ikke luminoforene som tilfellet er med andre kilder til beta -stråling, og forlenget enhetene til enhetene.
Men når det ble oppdaget at lovende også er farlig, er bruken av den i markedet som skinner i mørket.
Risiko
PM er et radioaktivt element, så den må manipuleres med ekstrem forsiktighet og med behørig beskyttelse. I tillegg til beta -partiklene som den avgir, kan disse påvirke elementene med et stort atomnummer og generere x -strål.
 Prometio -prøver må transporteres innenfor et tykt blyskjold for å unngå skadelige effekter av strålingen de avgir. Energi.GOV / PUB -domene. Kilde: Wikimedia Commons.
Prometio -prøver må transporteres innenfor et tykt blyskjold for å unngå skadelige effekter av strålingen de avgir. Energi.GOV / PUB -domene. Kilde: Wikimedia Commons. Referanser
- ELLER.S. National Library of Medicine. (2019). Promethium - PM (element). Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Ganjali, m.R. et al. (2016). Introduksjon til Lanthanide Series (fra Lanthanum til Lotetium). Promethium. I Lanthanides serie bestemmelse ved forskjellige analysemetoder. Gjenopprettet fra Scientedirect.com.
- Choppin, g. et al. (2013). Opprinnelsen til universet og nukleosyntesen. Langsom nøytronfangst. I RadioChemistry and Nuclear Chemistry (fjerde utgave). Gjenopprettet fra Scientedirect.com.
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Royal Society of Chemistry. (2020). Promethium. RSC kom seg.org.
- « Forskningsvariabler typer, egenskaper og eksempler
- Metoder for separasjon av homogene blandinger »

