Egenskaper til kovalente forbindelser (med eksempler)
- 2001
- 356
- Prof. Joakim Johansen
De Karakteristikk av kovalensforbindelser De vises i mange faktorer som er avhengige av molekylære strukturer. Til å begynne med må den kovalente bindingen forene atomene sine, og det kan ikke være noen elektriske ladninger; Ellers ville vi snakke om ioniske eller koordinasjonsforbindelser.
I naturen er det for mange unntak der skillelinjen mellom de tre typene forbindelser blir diffus; Spesielt når de regnes som makromolekyler, i stand til å beskytte både kovalente og ioniske regioner. Men generelt skaper kovalente forbindelser enkle og individuelle enheter eller molekyler.
 Kysten av en strand, et av de uendelige eksemplene på kilder til kovalente og ioniske forbindelser. Kilde: Pexels.
Kysten av en strand, et av de uendelige eksemplene på kilder til kovalente og ioniske forbindelser. Kilde: Pexels. Gassene som utgjør atmosfæren og brisen som treffer skjortene er ikke annet enn flere molekyler som respekterer en konstant sammensetning. Oksygen, nitrogen, karbondioksid, er diskrete molekyler med kovalente bindinger og er intimt involvert i planetens liv.
Og på den marine siden er vannmolekylet, O-H-O, Excellence-eksemplet på en kovalent forbindelse. På kysten kan du se på sanden, som er en kompleks blanding av eroderte silisiumoksider. Vann er flytende ved romtemperatur, og denne egenskapen vil være viktig å huske på andre forbindelser.
[TOC]
Kovalent binding
Det ble nevnt i innledningen at de siterte gassene har kovalente bindinger. Hvis molekylære strukturer kjører, vil det sees at koblingene dine er doble og trippel: O = O, N≡N og O = C = O. På den annen side har andre gasser enkle koblinger: H-H, CL-CL, F-F og CH4 (Fire C-H-koblinger med tetrahedral geometri).
Et kjennetegn ved disse koblingene, og derfor av de kovalente forbindelsene, er at de er retningskrefter; Det går fra det ene atomet til det andre, og dets elektroner, med mindre det er resonans, er lokalisert. Mens i ioniske forbindelser er interaksjoner mellom to ioner ikke -retning: de tiltrekker og frastøter de andre omgivende ionene.
Kan tjene deg: kromhydroksid: struktur, egenskaper, syntese, brukOvennevnte innebærer umiddelbare konsekvenser på egenskapene til kovalente forbindelser. Men med henvisning til koblingene kan du, forutsatt at det ikke er noen ioniske belastninger, for å bekrefte at en forbindelse med enkle, doble eller trippelkoblinger er kovalent; Og enda mer, når dette er kjedestrukturer, funnet i hydrokarboner og polymerer.
 Noen kovalente forbindelser er koblet sammen med flere koblinger, som om de var kjeder. Kilde: Pexels.
Noen kovalente forbindelser er koblet sammen med flere koblinger, som om de var kjeder. Kilde: Pexels. Hvis det i disse kjedene ikke er noen ioniske ladninger, som i Teflon -polymeren, sies det at de er rene kovalente forbindelser (i kjemisk forstand og ikke sammensetning).
Molekylær uavhengighet
Ettersom kovalente bindinger er retningskrefter, ender de alltid opp med å definere en diskret struktur, i stedet for et tre -dimensjonalt arrangement (som oppstår med krystallinske strukturer og nettverk). Fra kovalente forbindelser kan det forventes små, middels, ringformede, kubikk eller med annen type struktur.
Blant de små molekylene er for eksempel gasser, vann og andre forbindelser som: i2, Br2, P4, S8 (med kronstruktur), som2, og silisium- og karbonpolymerer.
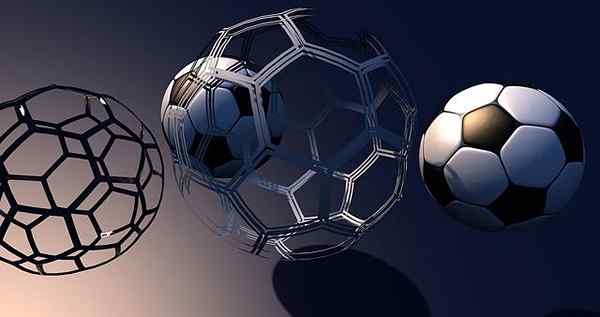
Hver av dem har sin egen struktur, uavhengig av naboens koblinger. For å understreke dette, vurderes alotropen av karbon, fulleren, C60:
 Fullerenos, en av de mest interessante alotropene i karbon. Kilde: Pixabay.
Fullerenos, en av de mest interessante alotropene i karbon. Kilde: Pixabay. Merk at det er fotballballform. Mens ballene kan samhandle med hverandre, er det deres kovalente bindinger som definerte den symbolske strukturen; Det vil si at det ikke er noe smeltet nettverk av krystallinske baller, men atskilt (eller komprimert).
Imidlertid er molekyler i det virkelige liv ikke alene: de samhandler med hverandre for å etablere en synlig gass, væske eller fast stoff.
Det kan tjene deg: Kalsiumnitrat (CA (NO3) 2)Intermolekylære krefter
De intermolekylære kreftene som holder individuelle molekyler avhenger av enormt grad av deres struktur.
Apolare kovalente forbindelser (for eksempel gasser), samhandler gjennom visse typer krefter (spredning eller London), mens polare kovalente forbindelser (for eksempel vann), samhandler av andre typer krefter (dipol-dipolo). Alle disse interaksjonene har noe til felles: de er retningsbestemt, og det samme er kovalente bindinger.
For eksempel interagerer vannmolekyler gjennom hydrogenbroer, en spesiell type dipol-dipolo-krefter. De plasserer seg på en slik måte at hydrogenatomer peker på oksygenatomet i et nærliggende molekyl: h2Eller - h2ENTEN. Og derfor presenterer disse interaksjonene en spesifikk retning i rommet.
Å være de intermolekylære kreftene av rent retningsbestemte kovalente forbindelser, gjør at molekylene deres ikke kan være sammenhengende like effektivt som ioniske forbindelser; og resultatet, koke- og fusjonspunktene som har en tendens til å være lave (t< 300°C).
Følgelig er kovalente forbindelser ved romtemperatur vanligvis myke, flytende eller myke faste stoffer, siden bindingene deres kan rotere, noe som gir fleksibilitet til molekyler.
Løselighet
Løseligheten av kovalente forbindelser vil avhenge av den oppløsningsløsende affiniteten. Hvis de er apoler, vil de være oppløselige i apolare løsningsmidler som diklormetan, kloroform, toluen og tetrahydrofurano (THF); Hvis de er polare, vil de være oppløselige i polare løsningsmidler, for eksempel alkoholer, vann, iseddik, ammoniakk, etc.
Imidlertid, utover slik oppløsningsløsningsaffinitet, er det en konstant i begge tilfeller: kovalente molekyler bryter ikke (bortsett fra visse unntak) koblingene deres eller desintegrerer atomene deres. Salter, for eksempel, blir deres kjemiske identitet ødelagt når de løses opp, og løser ionene sine hver for seg.
Kan tjene deg: Polyvinylpirrolidon: Struktur, egenskaper, bruksområder, bivirkningerKonduktivitet
Når de er nøytrale, bidrar de ikke til tilstrekkelig virksomhet for å ha migrasjon av elektroner, og derfor er de dårlige ledere av strøm. Noen kovalente forbindelser, så som hydrogenhalogenider (HF, HCl, HBR, HI), dissosierer imidlertid deres kobling til opprinnelige ioner (h+: F-, Cl-, Br-...) Og de forvandles til syrer (hydraceids).
De er også dårlige drivere av varme. Dette er fordi deres intermolekylære krefter og vibrasjonene av bindingene deres absorberer en del av varmen som leveres før molekylene øker energien.
Krystaller
De kovalente forbindelsene, forutsatt at deres intermolekylære krefter er tillatt, kan bestilles på en slik måte at de skaper et strukturelt mønster; Og så, en kovalent krystall, uten ioniske belastninger. I stedet for et ionettverk er det et nettverk av molekyler eller kovalent koblede atomer.
Eksempler på disse krystallene er: sukker generelt, jod, DNA, silikaoksider, diamanter, salisylsyre, blant andre. Med unntak av diamanten har disse kovalente krystaller mange mindre punkter enn i ioniske krystaller; det vil si uorganiske og organiske salter.
Disse krystallene motsier eiendommen at kovalente faste stoffer har en tendens til å være myke.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Leenhouts, Doug. (13. mars 2018). Kjennetegn på ioniske og kovalente forbindelser. Scienting. Gjenopprettet fra: Scienting.com
- Toppr. (s.F.). Kovalente forbindelser. Gjenopprettet fra: Toppr.com
- Helmestine, Anne Marie, PH.D. (5. desember 2018). Kovalente eller molekylære forbindelsesegenskaper. Gjenopprettet fra: Thoughtco.com
- Wyman Elizabeth. (2019). Kovalente forbindelser. Studere. Gjenopprettet fra: Studie.com
- Ophardt c. (2003). Kovalente forbindelser. Virtual Chembook. Gjenopprettet fra: Kjemi.Elmhurst.Edu
- Dr. Gergens. (s.F.). Organisk kjemi: Kjemi av karbonforbindelser. [PDF]. Gjenopprettet fra: lekser.Sdmesa.Edu
- Quimitube. (2012). Egenskaper til molekylære kovalente stoffer. Gjenopprettet fra: Quimitube.com

