Proteolysetyper og funksjoner
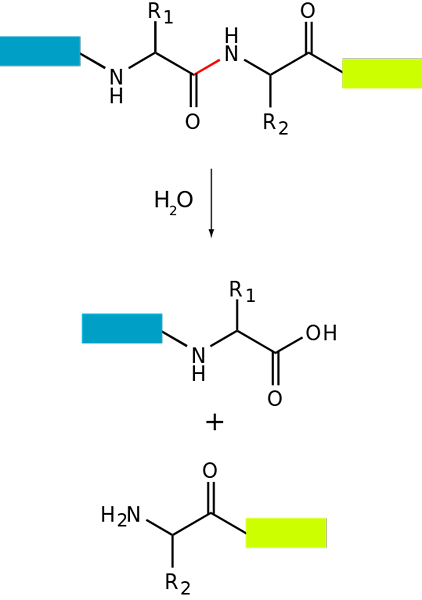
- 3605
- 477
- Theodor Anders Hopland
De Proteolyse o Proteinnedbrytning er en prosess der et celleproteiner kan bli fullstendig nedbrutt (til og med deres konstituerende aminosyrer) eller delvis (produserer peptider). Det vil si at den består av hydrolyse av en eller flere av peptidlenene som holder aminosyrene sammen.
Denne prosessen kan skje takket være deltakelse av andre proteiner med enzymatisk aktivitet, hvis aktive steder hydrolyse av koblingene oppstår. Det kan også oppstå ved ikke -enzymatiske "metoder", for eksempel ved handling av varme eller stoffer med ekstrem pH (veldig sur eller veldig grunnleggende).
 Grunnleggende proteolyseskjema for et protein (Kilde: FDARDEL [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons)
Grunnleggende proteolyseskjema for et protein (Kilde: FDARDEL [CC BY-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0)] via Wikimedia Commons) Proteinnedbrytning forekommer både i bakterier og dyr og planter, men det er spesielt vanlig hos dyr, spesielt på fordøyelsessystemnivå, siden det avhenger av fordøyelsen og tarmabsorpsjonen av proteinene som er inntatt med kostholdet.
I tillegg er proteolyse av største betydning for funksjonell vedlikehold og regulering av flere cellulære prosesser og har også å gjøre med eliminering av proteiner som har translasjon, folding, emballasje, import, drift, etc.
Det er viktig å merke seg at det er en irreversibel, ekstremt effektiv prosess som også fungerer i "reguleringen av regulatorer", siden den ikke bare eliminerer de proteiner som har "direkte" biologiske aktiviteter, men også de som regulerer andre proteiner eller uttrykket av de tilsvarende genene.
[TOC]
Typer proteolyse
Interne proteiner av en celle kan bli tilfeldig eller selektivt nedbrutt eller, det som er like, kontrollert eller ikke. Som tidligere nevnt kan denne prosessen skje gjennom spesielle enzymer eller på grunn av miljøforhold definert som sur og/eller alkalisk pH.
Kan tjene deg: epitelbeleggvevDet er viktig å nevne at ethvert riktig oversatt protein, brettet eller pakket skjuler en eller flere sekvenser av nedbrytningssignaler som er "kryptiske" og som kan utsettes når proteinet er strukturelt forstyrret av temperatur, pH, pH, etc.
Ubiquitineringsproteolyse
Ubiquitinering (ubiquitin-proteosomsystem) er et system som proteiner kan selektivt hydrolyseres etter å ha blitt spesifikt markert for nedbrytning, en prosess som kan oppstå både i cytosol og i cellekjernen.
Dette systemet har evnen til å gjenkjenne og ødelegge proteiner merket i kjernen og i cytosol, samt å nedbryte proteiner som ikke brettes riktig under translokasjonen fra cytosol til endoplasmatisk retikulum.
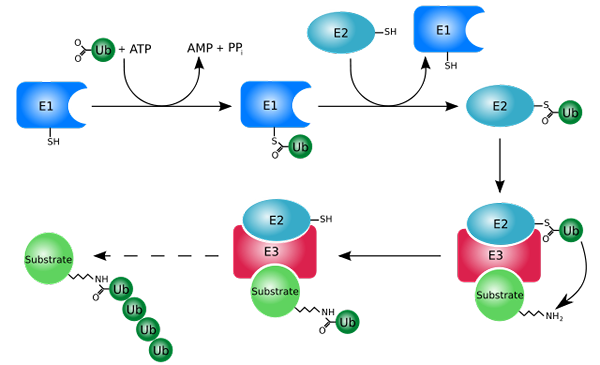 Merkingsprosess med ubiquitinas (ubiquitination) (Kilde: Rogerdodd [CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons)
Merkingsprosess med ubiquitinas (ubiquitination) (Kilde: Rogerdodd [CC By-SA (http: // CreativeCommons.Org/lisenser/by-SA/3.0/)] via Wikimedia Commons) Det fungerer hovedsakelig ved å tilsette eller konjugere de "hvite" proteinene til et lite protein eller peptid med 76 aminosyreavfall, bedre kjent som ubiquitin. De "markerte" proteiner ved ubiquitinering blir degradert i små fragmenter av 26S -proteosomet, en protease av flere underenheter.
Autofagi proteolyse
Autofagi anses også av noen forfattere som en form for proteolyse, med skillet at dette skjer inne i et lukket membranrom som er rettet mot lysosomer (i dyreceller), hvor proteiner som er inne i lysosomale proteaser) blir nedbrutt av lysosomale proteaser.
Ikke -enzymatisk proteolyse
Temperaturen, pH og til og med konsentrasjonen av salter av et medium kan forårsake hydrolyse av peptidbindingene som holder aminosyrene til forskjellige typer proteiner sammen, som oppstår ved destabilisering og avbrudd i koblingene.
Funksjoner
Proteolyse har mange funksjoner i levende organismer. Spesielt har det å gjøre med proteinutskifting.
Kan tjene deg: ribosomer: egenskaper, typer, struktur, funksjonerProteiner har en halvliv som varierer fra noen få sekunder til noen måneder, og produktene fra deres nedbrytning, enten de er regulert eller ikke, mediert av enzymer eller ikke, de blir generelt gjenbrukt for syntesen av nye proteiner, som sannsynligvis oppfyller forskjellige funksjoner.
Dette er hva som skjer med proteinene som konsumeres med mat, som blir degradert i mage -tarmkanalen ved proteaser, inkludert tripsin og pepsin; så vel som med noen celleproteiner når celler mangler nok mat til å overleve.
Intracellulære proteolytiske systemer oppdager og eliminerer "unormale" proteiner som potensielt er giftige for celler, da de kan samhandle med "fysiologisk upassende" ligander, i tillegg til å produsere aggregater som forårsaker mekaniske og fysiske hindringer for normale cellulære prosesser.
Akkumulering av unormale proteiner inne i celleinteriør, enten på grunn av defekter i det interne proteolytiske systemet eller av andre grunner, er det mange forskere anser som en av de viktigste årsakene til aldring i flercellulær levende vesener.
I immunforsvaret
Den delvise proteolysen av mange proteiner fra eksogene eller utenlandske kilder som invaderende mikroorganismer, for eksempel, er en grunnleggende prosess for immunresponssystemet, siden T -lymfocytter gjenkjenner korte fragmenter, produkt av proteolyse (peptider) som presenteres for dem i forbindelse med tilknytning til produkt av proteolyse (peptider) et overflateproteinsett.
Disse peptidene kan komme fra ubiquitineringssystemet, autofagiske prosesser eller ikke kontrollerte proteolysehendelser.
Andre funksjoner
En annen funksjon av begrenset eller delvis proteolyse er modifisering av nydannede proteiner, som fungerer som et "preparat" for sine intra-ekstracellulære funksjoner. Dette er for eksempel for visse hormoner og for proteiner som er involvert i forskjellige metabolske prosesser.
Det kan tjene deg: Lymphaopoyesis: Kjennetegn, stadier, reguleringDen programmerte celledøden (apoptose) avhenger også i stor grad av den "stedsspesifikke" proteolyse, begrenset eller delvis av intracellulære proteiner, som er mediert av et fossefall av spesifikke proteaser kalt caspases.
Ekstracellulære reguleringssystemer er også avhengig av stedsspesifikk proteolyse, og det mest enestående eksemplet er det av blodkoagulasjon.
Generell eller fullstendig proteolyse oppfyller også primære funksjoner for selektiv nedbrytning av de proteiner hvis konsentrasjon må kontrolleres nøye avhengig av fysiologisk, metabolsk eller celleutviklingstilstand.
I planter
Planter bruker også proteolytiske prosesser for kontroll av mange av deres fysiologiske og utviklingsaspekter. Det fungerer for eksempel ved å opprettholde intracellulære forhold og i mekanismene for respons på stressende forhold som tørke, saltholdighet, temperatur, blant andre.
Så vel som hos dyr, proteolyse i grønnsak. I disse organismer er proteolyse ved ubiquitinering en av de viktigste.
Referanser
- Alberts, f., Bray, d., Hopkin, k., Johnson, a. D., Lewis, J., Raff, m.,… & Walter, P. (2013). Essensiell cellebiologi. Garland Science.
- Maurizi, m. R. (1992). Proteaseres og protein -nedbrytning i Escherichia coli. Experientia, 48 (2), 178-201.
- Varshavsky, a. (2005). Regulert proteinnedbrytning. Trender i biokjemiske vitenskaper, 30 (6), 283-286.
- VIERSTRA, R. D. (nitten nittiseks). Proteolyse i planter: Mekanismer og funksjon. I post-transkripsjonell kontroll av genuttrykk i planter (PP. 275-302). Springer, Dordrecht.
- Wolf, d. H., & Messen, r. (2018). Mekanismer for celleforordningsproteolyse, den store overraskelsen. FEBS Letters, 592 (15), 2515-2524.
- « Paradise Ave -egenskaper, habitat, egenskaper, reproduksjon, omsorg
- Trypanosoma Cruzi -egenskaper, livssyklus, sykdommer, symptomer »

