Oxidase Test Foundation, prosedyre og bruk
- 919
- 112
- Prof. Oskar Aas
De oksidasetest Det er en diagnostisk metode som viser tilstedeværelsen av det enzymatiske komplekset kalt cytokrom oksidase C. Dette systemet induserer transformasjonen av redusert til oksidert cytokrom, siden det fanger oksygen og dette igjen fungerer som den siste elektronakseptoren (h+) I luftveiene.
Oksidasebegrepet er en sammendrag måte å referere til cytokrom oksidaseenzym, også kjent som oksidase indefenol. I eldgamle tider ble det antatt at cytokrom oksidase- og uavhengigofenoloksidase -enzymer var to forskjellige enzymer, men i dag er det kjent at de er de samme.
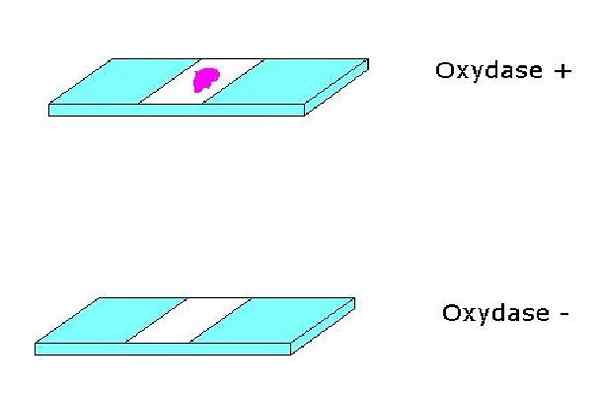
 Positiv og negativ oksidasetest. Kilde: Ingen maskinlesbar forfatter gitt. Alfa.Prim ~ Commonswiki antatt (basert på krav om opphavsrett)). [Offentlig domene]
Positiv og negativ oksidasetest. Kilde: Ingen maskinlesbar forfatter gitt. Alfa.Prim ~ Commonswiki antatt (basert på krav om opphavsrett)). [Offentlig domene] For deres del er cytokromer hemoproteiner som inneholder jern og fullfører cytokromoksidasesystemet. Cytokromer kan variere fra en art til en annen.
Det er forskjellige varianter av cytokromer (cytokromer A1, A2, A3 og 0). Noen bakterier kan bare produsere en, men andre opptil to eller tre samtidig. I denne forstand er tilstedeværelsen av cytokrom A og A3 kjent som cytokrom - oksidase C. Dette er den typen cytokrom som oppdager oksidasetesten.
Neisseria og Pseudomonas sjangre inneholder oksidase C cytokrom. Disse sjangrene gir den positive oksidasetesten, og hjelper dem med å skille dem fra henholdsvis Acinetobacter og Stenotrophomonas Sjangre.
Det er også andre sjangre som er positiv oksidase.
[TOC]
Basis
Kjennetegn på cytokromoksidasesystemet C
Oksidase -cychocromesystemet C fungerer som følger: Positive oksidase -mikroorganismer bruker oksygen for å generere energi gjennom aerob pust. Dette systemet fungerer takket være transport av elektroner fra donorstoffer som NADH+ Mot å motta stoffer, i dette tilfellet oksygen.
Dette resulterer i energi (ATP) og vannperoksyd, avhengig av oksidase -cytokrom -systemet som besitter mikroorganismen.
Det er grunnen til at de fleste positive oksidasebakterier også er positive katalase, en nødvendig tilstand for å eliminere hydrogenperoksyd produsert, siden dette stoffet er giftig for bakterier.
Oksidase C -cytokromsystemet er til stede i noen aerobe bakterier, visse valgfrie anaerob, knapp mikroaerofil og ingen streng anaerob. Det siste er forståelig, siden strenge anaerober ikke kan leve i nærvær av oksygen, derfor mangler de cytokrom oksidasesystem.
Bevisprinsipp
I denne testen bruker stoffer som fungerer som kunstige elektronakseptorer, og erstatter innfødte i elektrontransportkjeden.
Hovedsakelig fargestoffer som parafenylendiamin og indofenol brukes, som fungerer som reseptorsubstrater og kunstige elektrontonorer.
Parafenyndiamin oksideres av cytokromoksidase C -systemet. Fargestoffet i sin reduserte form er fargeløst, men i sin oksiderte form er det farget.
Slik er tilstedeværelsen av cytokrom oksidase C -systemet C; Vel, en positiv reaksjon vil generere en lavendel eller blå farge -púrpura avhengig av reagenset som brukes.
Kan tjene deg: paleobiologi: historie, spesialiteter, funnPå den annen side, hvis det siste elektronakseptorstoffet i luftveiene er forskjellig fra oksygen, vil oksidasetesten gi negativ (det er ingen fargeproduksjon); Dette er tilfelle av anaerobe mikroorganismer.
På samme måte, hvis cytokrom som brukes av mikroorganismen er forskjellig fra cytokrom oksidase C, vil det også gi den negative testen.
Fremgangsmåte
For oksidasetesten er det flere reagenser og protokoller, alle med samme formål.
Reagenser
Kovacs Reactive, Gordon og McLeod Reagent, Nadi Reagent, Carpenter Reagent, Suhrland og Morrison, og bruk av oksidaseskiver.
-Kovacs oksidase -reagens
Den består av tetrametyl-P-fenylendiamindiklorhydrat ved 1%.
KOVACS -reagenset fremstilles ved å løse opp 1 GR av stoffet nevnt i 50 ml destillert vann. Den er subtilt oppvarmet til den totale løsningen. Overfør til en ravflaske med tilstrekkelig kapasitet og fullfør volumet med 100 ml med destillert vann. Vent minst 15 minutter før du bruker. Spar i kjøleskap beskyttet mot lys.
Det roteres som et Kovacs oksidase -reagens, for å skille det fra Kovacs -reagenset som ble brukt til å avsløre Indol -testen. Dette reagenset er det mest følsomme, mindre giftige, men dyrere enn resten av reagensene.
En positiv reaksjon vil være bevis. En negativ reaksjon er vist fordi det ikke er noen fargeendring i kolonien eller den tar en svak rosa farge. Mediet kan også mørkere, men det betyr ikke positiv reaksjon.
Med dette reagenset er reaksjonstiden avgjørende, den fargeendringen som oppstår mellom 5 og 15 sekunder anses som en positiv reaksjon.
-Gordon og McLeod Reagent
Det er sammensatt av dimetyl-P-fenylendiamindiklorhydrat, også kjent som N-dimetyl-P-fenylendiamin eller p-amynodimetylanilin p-amocorhydrat. Det er fremstilt som beskrevet for Kovacs oksidase -reagens, og erstatter stoffet som er involvert.
Dette reagenset er litt mer stabilt enn Kovacs oksidase-reagens, selv om alle reagenser som inneholder P-penilendiamin er ustabile.
Denne reaksjonen er sent.
-Nadi -reagens
Det er sammensatt av 1% a-naftol i etylalkohol (95% etanol) og 1% Amin-Limanylin. Blandingen tilberedes i like deler og bruker absolutt etylalkohol som en flittig, til tilstrekkelig mengde er fullført for 100 ml.
-Carpenter Reactive, Suhrland og Morrison
Det er sammensatt av 1% p-amynodimetylalanin oksalat. Forbered deg på samme måte til det som er beskrevet for Kovacs oksidase -reagens, og endret for det tilsvarende stoffet.
Kan servere deg: næringskjeden til jungelenMed løsningen klar, er reaktive strimler utarbeidet som følger: Whatman 6-8 cm nummer 1.
De har lov til å tørke uten å ha kontakt med metall, lagre i krukker tråden med tørkemiddel og oppbevar i kjøleskapet. Disse stripene er stabile i opptil 6 måneder.
Det er det mest stabile reagenset av alle nevnte, og kan vare i løsning opp til 6 måneder. Et annet punkt for favør er at mediet ikke fargelegger rundt kolonien, hvis det brukes direkte på platen.
Utseendet til en rød farge tolkes som en positiv test.
-Oksidaseskiver
De er kommersielle plater som er impregnert med reagens for oksidasetest. Det er flere kommersielle merker i markedet.
Bruken er ganske praktisk, siden vi ikke må forberede ferske reagenser, noe som letter arbeidet. Resultatene som er oppnådd er pålitelige så lenge platene er riktig bevart.
Protokoller
Direkte platemetode, indirekte metode på papir og bruk av impregnerte plater med oksidase -reagenser.
-Direkte plate -metode
2 eller 3 dråper av noen av de nevnte reagensene tilsettes for dette formålet direkte på kolonien (e) som er inneholdt i en kulturmedium plate som ikke inneholder glukose.
Endringen eller ikke fargen på koloniene tolkes, ikke mediet. Den gyldige reaksjonstiden avhenger av reagenset som brukes.
-Indirekte metode på papir
Klipp et filterpapir (Whatman N ° 1) til en størrelse på 6 cm2 Og den er plassert inne i en tom petrisk.
Tilsett 2 eller 3 dråper av Kovacs oksidase -reagens på papir, ta del i kolonien som du vil studere med et platinahåndtak eller trepinne og forlenge den i en rett linje på det impregnerte reagenspapiret. Tolke i en periode på 5 til 10 sekunder.
Med stripene tilberedt med snekkeren, strekker Suhrland og Morrison Reagent en koloni på den tørre stripen. Den samme stripen tjener til å prøve flere stammer. Tolke på 10 sekunder.
-Plater (mdirekte ethod)
Subtilt fuktige kommersielle plater med sterilt destillert vann og overvinne kolonien for å studere. Det anbefales å bruke platene ved 35 ° C, hvis platene brukes ved romtemperatur eller nedkjølte plater er reaksjonen litt tregere. Tolke fargeendringen mellom 10 til 20 sek.
Kolonier inneholdt i blod eller sjokolade kan brukes.
-Plater (indirekte metode)
Fukt albumet som beskrevet ovenfor. Plasser den på en tom petri. Ta tilstrekkelig mengde kolonien til å studere med et platinahåndtak eller trepinne og plasser på platen. Tolke fargeendringen mellom 10 til 20 sek.
Bruk
Slekten Neisseria og Acinetobacter ligner noen ganger mye morfologisk fordi selv om Acinetobacter -sjangeren er en gram negativ bacillus, kan den noen ganger ta i bruk en kokoid form og distribuere parvis, simulere slekten Neisseria.
Kan tjene deg: limnologiI dette tilfellet er oksidasetesten virkelig nyttig. Kjønn Neisseria er positiv og negativ acinetobacter.
Imidlertid er slekten Moraxella veldig lik slekten Neisseria og begge gir positiv reaksjon; Det er grunnen til at vi alltid må utføre karbohydratfermenteringstester for definitiv identifikasjon.
På den annen side er oksidasetesten nyttig for å differensiere en bakterie som tilhører Enterobacteriaceae -familien (alle negative oksidase) av andre fermer, som pasturel -slekten, aeromoner, plesiomonas (positiv oksidase).
Slekten Vibrio og Helicobacter er også positiv oksidase.
QA
Bruk kjente stammer av Escherichia coli som negativ kontroll og stammer av Pseudomonas aeruginosa som positiv kontroll.
Begrensninger
-Reagenser må brukes nylaget, deres levetid i romtemperatur er kort for å være veldig ustabil. Kjøleskap kan vare mellom 5 dager og 2 uker.
-Reagensene er fargeløse, hvis de endrer farge, må de kastes. Skadede plater er tydelige fordi de blir mørke over tid.
-En positiv reaksjon med oksidase -reagenset til Kovacs mellom 15-60 sekunder anses som en forsinket reaksjon, og etter 60 sekunder bør den betraktes som negativ.
-Han Haemophylus influenzae Det gir en negativ oksidase-reaksjon hvis noe reagens med dimetyl-P-fenylendiamin brukes, men positivt hvis oksidase-reagenset til Kovacs (tetrametyl-P-fenylendiamin) brukes nyttig).
-Media som inneholder glukose forstyrrer testen, falskt negativ.
-Belastningene til Bordetella kikhoste De kan gi falskt positiv reaksjon hvis de kommer fra veldig konsentrerte blodagarplater.
-Bruk av metallhåndtak (jern) som gir falsk positiv reaksjon.
Anbefalinger
-Fordi reagensene er veldig ustabile og har en tendens til å selv-ut.
-En annen måte å utsette reagensens selvutløp er å tilsette 0,1% askorbinsyre på tidspunktet for å fremstille reagenser.
-Ettersom reagenser er ustabile anbefales det å utføre ukentlig kvalitetskontroll.
-Reagenser som ikke består av kvalitetskontrolltesten, skal ikke brukes.
Referanser
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Mikrobiologisk diagnose. 5. utg. Pan -American redaksjon S.TIL. Argentina.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott mikrobiologisk diagnose. 12 Ed. Pan -American redaksjon S.TIL. Argentina.
- "Oksidasetest."" Wikipedia, gratis leksikon. Jan 2018, 10:32 UTC. Apr 2019, 14:03
- Verdens helseorganisasjon. Laboratoriehåndbok for identifisering og test av mottakelighet for antimikrobianere av bakteriske patogener av betydning for folkehelsen i utviklingsverdenen.2004. Tilgjengelig på: hvem.Int/drugresistance/infosharing
- Reaktive strimler for diagnose av oksidaseaktivitet i bakterier. Cuban rev. 2000; 52 (2): 150-151.

