Isotoniske løsningskomponenter, forberedelser, eksempler
- 2399
- 666
- Prof. Oskar Aas
EN Isotonisk løsning Det er en som presenterer den samme konsentrasjonen av løst stoff med hensyn til en løsning atskilt eller isolert med en semipermeabel feil. Denne barrieren lar løsningsmidlet Transte, men ikke alle oppløst partikler.
I fysiologi refererer denne isolerte løsningen til intracellulær væske, det vil si det indre av cellene; Mens den semipermeable barrieren tilsvarer cellemembranen, dannet av en lipid bilay.
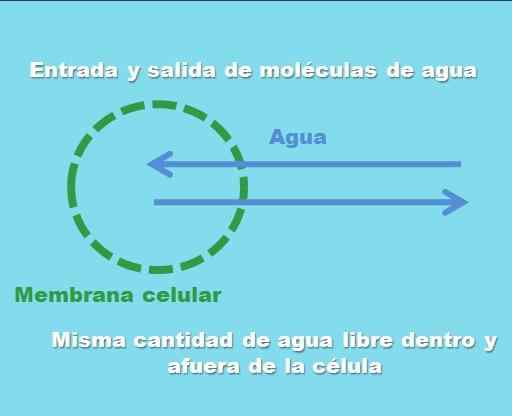
 Interaksjon av en celle med en isoton løsning. Kilde: Gabriel Bolívar.
Interaksjon av en celle med en isoton løsning. Kilde: Gabriel Bolívar. Det overordnede bildet illustrerer hva som menes med en isotonisk løsning. "Konsentrasjonen" av vann er den samme i og utenfor cellen, så molekylene deres kommer inn eller kommer ut gjennom cellemembranen med like frekvenser. Derfor, hvis to vannmolekyler kommer inn i cellen, vil to av dem forlate samtidig mot det ekstracellulære mediet.
Denne tilstanden, kalt isotonicitet, foregår bare når det vandige mediet, inne i og utenfor cellen, inneholder samme antall oppløste oppløstepartikler. Dermed vil en løsning være isoton hvis konsentrasjonen av oppløste stoffer er lik den for væsken eller intracellulært medium. For eksempel er 0,9% saltoppløsning isotonisk.
[TOC]
Komponenter av isotoniske løsninger
For at det skal være en isotonisk løsning, må den først sikre at osmosen oppstår i løsningen eller løsningsmidlet. Dette er bare mulig hvis det er en semipermeabel barriere, som lar løsningsmiddelmolekyler overføre den, men ikke de med løst stoff, spesielt elektrisk belastede oppløste stoffer, ioner.
Dermed kan ikke løsningen spres fra mer konsentrerte regioner til mer utvannede regioner. I stedet vil det være vannmolekylene som vil bevege seg fra et sted til et annet, krysse den semipermeable barrieren og finne sted osmosen. I vandige og biologiske systemer er denne barrieren par excellence cellemembranen.
Kan tjene deg: konkurranse (biologi): Kjennetegn, typer, eksemplerÅ ha en semipermebar barriere og et løsningsmiddelmedium, er tilstedeværelsen av oppløste ioner eller salter i begge medier også nødvendig: det indre (inne i barrieren) og det ytre (utenfor barrieren).
Hvis konsentrasjonen av disse ionene er den samme på begge sider, vil det ikke være noe overskudd eller underskudd av vannmolekyler for å løse dem. Det vil si at antallet vannfrie molekyler er det samme, og derfor vil de ikke overføre den semipermeable barrieren noe sted med det formål å matche konsentrasjonene til ionene.
Forberedelse
- Forhold og ligning
Selv om en isotonoppløsning kan fremstilles med et hvilket som helst løsningsmiddel, ettersom vann er mediet for cellene, regnes dette som favorittalternativet. Når du vet nøyaktig konsentrasjonen av salter i en spesifikk kropp av kroppen, eller i blodomløpet, er det mulig å estimere hvor mye salter det må oppløses i et gitt volum.
I virveldyrorganismer aksepteres det at konsentrasjonen av oppløsningene i blodplasmaet i gjennomsnitt er rundt 300 MOSM/L (miliosmolaritet), og kan tolke nesten som 300 mmol/l. Det vil si at det er en veldig utvannet konsentrasjon. For å estimere miliosmolariteten, må følgende ligning brukes:
Osmolaritet = m · v · g
For praktiske formål antas det at det g, Den osmotiske koeffisienten, har en verdi på 1. Slik at ligningen nå er som:
Osmolaritet = m · v
Hvor m Det er molariteten til løst stoffet, og v Antall partikler som nevnte løst dissosierer i vannet. Deretter multipliserer vi denne verdien med 1.000 for å oppnå miliosmolaritet for et bestemt oppløst stoff.
Kan tjene deg: Hva er homoplasia? (Med eksempler)Hvis det er mer enn ett oppløst stoff, vil den totale miliosolariteten til løsningen være summen av tusensmolaritetene for hvert oppløst stoff. Jo mer løst med hensyn til det indre av cellene, desto mindre vil isoton være den forberedte løsningen.
- Eksempel på forberedelse
Anta at du vil tilberede en liter en isotonoppløsning basert på glukose og natrium diácid fosfat. Hvor mye skal veie glukose? Anta at 15 gram nah vil bli brukt2Po4.
Første skritt
Vi må først bestemme nah osmolariteten2Po4 beregne dens molaritet. For å gjøre dette, vender vi oss til den molmasse eller molekylvekten, 120 g/mol. Fordi vi blir bedt om en liter løsning, bestemmer vi føflekkene, og vi vil direkte ha molaritet:
Føflekker (nah2Po4) = 15 g ÷ 120 g/mol
= 0,125 mol
M (nah2Po4) = 0,125 mol/l
Men når nah2Po4 Den oppløses i vann, frigjør et na -kation+ og en anion h2Po4-, Derfor v Den har en verdi på 2 i osmolaritetsligningen. Vi fortsetter å beregne da for nah2Po4:
Osmolaritet = m · v
= 0,125 mol/l · 2
= 0,25 OSM/L
Og ved å multiplisere det med 1.000 vi har miliosmolariteten til nah2Po4:
0,25 OSM/L · 1.000 = 250 MOSM/L
Andre trinn
Siden den totale miliosolariteten til løsningen må være lik 300 mosm/l, trekker vi til å vite hva glukosen skal være:
MOSM/L (glukose) = MOSM/L (Totalt) - MOSM/L (nah2Po4)
= 300 MOSM/L - 250 MOSM/L
= 50 mosm/l
Fordi glukose ikke dissosierer, v Vale 1 og dens osmolaritet er lik dens molaritet:
M (glukose) = 50 mosm/l ÷ 1.000
= 0,05 mol/l
Som molar for glukose 180 g/mol, bestemmer vi endelig hvor mange gram vi må veie for å oppløse den i den literen av isotonisk løsning:
Kan tjene deg: Renina: Struktur, produksjon, sekresjon, funksjonerMasse (glukose) = 0,05 mol · 180 g/mol
= 9 g
Derfor denne nah isotoniske løsningen2Po4/glukose tilbereder 15 gram nah2Po4 og 9 gram glukose i en liter vann.
Eksempler på isotoniske løsninger
Isotoniske løsninger eller væsker forårsaker ingen gradient eller endring i konsentrasjonen av ioner i kroppen, så deres handling fokuserer i hovedsak på å fuktige pasienter som får den i tilfelle blødning eller dehydrering.
Normal saltvann
En av disse løsningene er normal saltvann, med en 0,9% NaCl -konsentrasjon.
Ringer laktatløsning
Andre isotoniske løsninger som brukes til samme formål er det å ringe laktat, noe som reduserer surhet på grunn av dens buffer eller dempesammensetning, og Sorensens fosfatløsninger, som er sammensatt av fosfater og natriumklorid.
Ikke -vandige systemer
Isotonisitet kan også brukes på ikke -vandige systemer, for eksempel de der løsningsmidlet er en alkohol; Så lenge det er en semipermeabel barriere som favoriserer åpenhet av alkoholmolekyler og beholder løst partikler.
Referanser
- Fra Lehr Spilva, til. Og muktans, og. (1999). Guide til farmasøytiske spesialiteter i Venezuela. XXXVª -utgave. Globale utgaver.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Elsevier f.V. (2020). Isotonisk løsning. Hentet fra: Scientedirect.com
- Adrienne Brundage. (2020). Isotonisk løsning: Definisjon og eksempel. Studere. Gjenopprettet fra: Studie.com
- Felicitas Merino de la Hoz. (s.F.). Intravenøs seroterapi. University of Cantabria. [PDF]. Gjenopprettet fra: OCW.Unican.er
- Pharmaceutics and Compounding Laboratory. (2020). Oftalmiske preparater: Isotoniske buffere. Gjenopprettet fra: Pharmlabs.Unc.Edu

