Estere
- 2729
- 727
- Marius Aasen
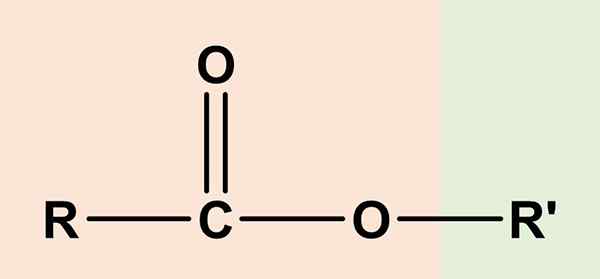
 Esteres er organiske forbindelser som har en komponent av karboksylsyre og en annen alkohol
Esteres er organiske forbindelser som har en komponent av karboksylsyre og en annen alkohol Hva er estere?
De estere De er organiske forbindelser som har en karboksylsyrekomponent og en annen alkohol. Den generelle kjemiske formelen er RCO2R' eller Rcoor'. Høyre side, RCOO, tilsvarer karboksylgruppen, mens høyre, eller' Det er alkohol. De to deler et oksygenatom og deler en viss likhet med eterne (ror ').
Av denne grunn acetatet til etyl, CH3Cooch2Ch3, Den enkleste av estere ble betraktet som Eddik eller eddikyreeter, Og derfra den etymologiske opprinnelsen til navnet 'ester'. Slik at en ester består i erstatning av det sure hydrogenet i COOH -gruppen, med en alkoholutleie fra en alkohol.
Hvor er esterne?
Fra jordsmonnene i organisk kjemi er det mange naturlige kilder. Den hyggelige lukten av frukt, som bananer, pærer og epler, er produktet av samspillet mellom estere med mange andre komponenter. De finnes også i form av triglyserider i oljer eller fett.
Kroppen vår produserer triglyserider fra fettsyrer, som har lange kullsyreholdige kjeder, og glyserolalkohol. Det som skiller noen estere fra andre ligger både i R, kjeden av syrekomponenten, som i R ', den av den alkoholholdige komponenten.
En ester med lav molekylvekt må ha få karbonatomer i R og R ', mens andre, for eksempel voks, har mange karbonatomer spesielt i R', den alkoholholdige komponenten, og derfor høye molekylvekter.
Imidlertid er ikke alle estere strengt organiske. Hvis karbonhelgruppeatomet i karbonylgruppen erstattes av en av fosfor, vil RPOOR ha '. Dette er kjent som en fosfatester, og er avgjørende betydning i strukturen til DNA.
Når et atom kan kobles effektivt til karbon eller oksygen, for eksempel svovel (rsoor '), kan det følgelig danne en uorganisk ester.
Estres egenskaper
Estere er ikke syrer eller alkoholer, så de oppfører seg ikke som sådan. Smelte- og kokepunktene, for eksempel, er lavere enn de med lignende molekylvekter, men nærmere verdiene til aldehyder og ketoner.
Butansyre, cho3Ch2Ch2COOH, har et kokepunkt på 164 ºC, mens etylacetat, CH3Cooch2Ch3, av 77.1. c.
Bortsett fra det nylige eksemplet, kokepunktene til 2-metylbutan3Ch (Ch3) Ch2Ch3, Metylacetat, cho3Cooch3, og 2-butanol, cho3,CH (OH) CH2Ch3, De er som følger: 28, 57 og 99º C. De tre forbindelsene har molekylvekter på 72 og 74 g/mol.
Lav molekylære pesosestere har en tendens til å være flyktige og har behagelig lukt, og det er grunnen til at innholdet i frukt gir dem familieduftene. På den annen side, når molekylvektene deres er høye, er de fargeløse og luktfrie krystallinske faste stoffer, eller avhengig av strukturen deres, kan de utvise fete egenskaper.
Vannløselighet
Karboksylsyrer og alkoholer er vanligvis oppløselige i vann, med mindre de har en høy hydrofob karakter i sine molekylære strukturer. Det samme gjelder estere. Når R eller R 'er korte kjeder, kan esteren samhandle med vannmolekyler gjennom dipol-dipolo og styrker fra London-styrker.
Kan tjene deg: kjemisk forbindelseDette er fordi estere er hydrogenbro -akseptorer. Som? For sine to Rcoor oksygenatomer '. Vannmolekyler kan danne hydrogenbroer med noen av disse oksygenene. Men når R- eller R -kjedene er veldig lange, frastøter de vannet i omgivelsene, noe som gjør det umulig for deres oppløsning.
Et åpenbart eksempel på dette skjer med triglyseridestere. Sidekjedene deres er lange og lager oljer og fett uoppløselige i vannet, med mindre de er i kontakt med et mindre polært løsningsmiddel, mer relatert til disse kjedene.
Hydrolysereaksjon
Esteres kan også reagere med vannmolekyler i det som er kjent som hydrolysereaksjon. Imidlertid krever de et syre- eller grunnleggende miljø for å fremme mekanismen for nevnte reaksjon:
Rcoor ' + H2ENTEN RCOÅh + R'oH
(Sur halvparten)
Vannmolekylet tilsettes karbonylgruppen, C = O. Syrehydrolyse er oppsummert ved utskifting av hver r 'av den alkoholiske komponenten av en OH fra vann. Legg også merke til hvordan esteren "bryter" i sine to komponenter: karboksylsyre, rcooh og r'oh alkohol.
Rcoor ' + Åh- => RCOENTEN- + R'oH
(Grunnleggende medium)
Når hydrolyse utføres i et grunnleggende medium, oppstår en irreversibel reaksjon kjent som Saponifisering. Dette er veldig ansatt og er hjørnesteinen i utdyping av håndverk eller industrielle såper.
RCOO- Det er karboksylatanionen, stabil, som er assosiert elektrostatisk med den dominerende kationen i midten.
Hvis basen som brukes er NaOH, dannes saltet. Når esteren er et triglyserid, som per definisjon har tre R -sidekjeder, dannes tre fettsyresalter, rcoone og glyserolalkohol.
Reduksjonsreaksjon
Estere er sterkt oksiderte forbindelser. Det betyr at det har flere kovalente bindinger med oksygen. Ved å eliminere C-O-bindinger oppstår det en pause som ender opp med å skille syre- og alkoholholdige komponenter; Og enda mer reduseres syre til en mindre oksidert måte, til en alkohol:
Rcoor '=> rch2Oh + r'oh
Dette er reduksjonsreaksjonen. Et sterkt reduserende middel er nødvendig, for eksempel litium og aluminiumhydrid, Lialh4, og av et surt medium som fremmer elektronmigrasjon. Alkoholer er de minste formene, det vil si de som har mindre kovalente bindinger med oksygen (bare en: C-OH).
De to alkoholer, RCH2Oh + r'oh, kommer fra de to respektive kjedene til den opprinnelige esteren Rcoor '. Dette er en metode for syntese av verdi -tilsatte alkoholer fra estere.
For eksempel, hvis du ønsket å produsere en alkohol av en eksotisk estere, ville dette være en god rute for det formålet.
TORDERIFIKASJONSREATION
Estere kan transformeres til andre hvis de reagerer til sure eller grunnleggende medier med alkoholer:
Rcoor ' + R "Å RCOEller " + R'oH
Esterstruktur
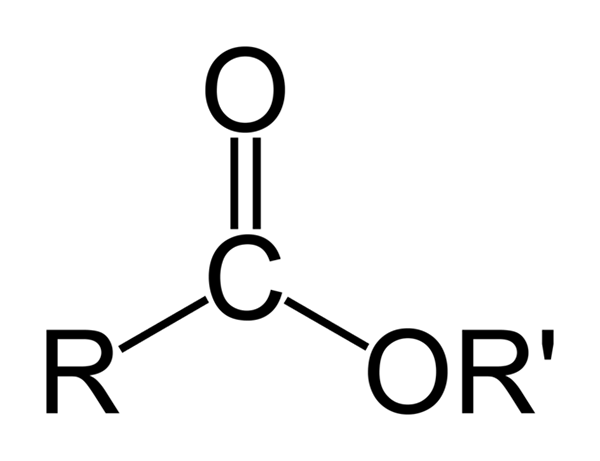 Generell kjemisk struktur av organiske estere. Kilde: Ben Mills via Wikipedia
Generell kjemisk struktur av organiske estere. Kilde: Ben Mills via Wikipedia Det overordnede bildet representerer den generelle strukturen til alle organiske estere. Merk at R, karbonylgruppen C = O, og eller ', danner en flat trekant, produkt av SP -hybridisering2 av det sentrale karbonatomet. Imidlertid kan andre atomer ta i bruk andre geometrier, og deres strukturer er avhengige av den iboende naturen til r eller r '.
Kan tjene deg: nitrater: egenskaper, struktur, nomenklatur, treningHvis R eller R 'er enkle alqulicas -kjeder, for eksempel av typen (velg2)nCh3, Du vil se Zigzagueada i verdensrommet. Dette er tilfellet med pentilo butanoat3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3.
Men i noen av karbonene i disse kjedene ble det funnet en gren eller umettethet (C = C, C≡C), som ville endre den globale strukturen til esteren. Og av denne grunn varierer dets fysiske egenskaper, for eksempel løselighet og dens kokende og fusjonspunkter, med hver forbindelse.
For eksempel har umettet fett dobbeltkoblinger i sine R -kjeder, noe som påvirker intermolekylære interaksjoner negativt. Som et resultat går smeltepunktene deres ned til de er flytende eller oljer, ved romtemperatur.
Hydrogenbro akseptor
Selv om bildet av esterne skiller seg ut mer, er det R- og R -kjedene som er ansvarlige for mangfold i strukturene sine.
Imidlertid er et strukturelt kjennetegn ved esterne fortjent til trekanten: de er hydrogenbro -akseptorer. Som? Av oksygen av karbonyl- og alcoxide -grupper (or ').
Disse har gratis elektronpar, som kan tiltrekke seg delvis positive hydrogenatomer av vannmolekyler.
Derfor er det en spesiell type dipol-dipol-interaksjoner. Vannmolekylene nærmer seg esteren (hvis r o r 'kjeder ikke forhindrer og broene dannes C = O-H2Eller, eller åh2-O-r '.
Nomenklatur av estere
For å navngi en ester på riktig måte er det nødvendig. Også enhver mulig gren, substituent eller umettethet.
Når dette er gjort, blir navnet på R 'of the Alcoxide Group -eller' Suffikset er lagt til -ilo, Mens karboksilo -Coor Group Chain R, suffikset -Ato. Først nevnes avsnitt R, etterfulgt av ordet 'av' og deretter navnet på r '-delen'.
For eksempel Cho3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3 Den har fem karbonatomer på høyre side, det vil si at de er de som tilsvarer r '. Og på venstre side er det fire karbonatomer (inkludert karbonylgruppen C = O).
Derfor er R 'en pentilgruppe, og R A Butane (for å inkludere karbonyl og med tanke på hovedkjeden). For å gi navn til forbindelsen, er det nok å legge til de tilsvarende suffikser og navngi dem i riktig rekkefølge: ButaneAto av pentilo.
Hvordan navngi følgende forbindelse: CH3Ch2Cooc (kap3)3? Kjeden -c (cho3)3 tilsvarer den rekto-butyl alquilical substituent. Ettersom venstre side har tre karbonatomer, er det en "propan". Hans navn er da: PropanAto av tert-menilo.
Hvordan dannes estere?
Forestring
Det er mange ruter å syntetisere Ester, hvorav noen til og med kan være roman. Imidlertid konvergerer de alle i det faktum at trekanten på bildet av strukturen må dannes, det vil si co-o-lenken. For det må det starte fra en forbindelse som tidligere har karbonylgruppen: som karboksylsyre.
Og hva skal karboksylsyre kobles? Til en alkohol, ellers ville det ikke ha den alkoholiserte komponenten som kjennetegner estere. Karboksylsyrer krever imidlertid varme og surhet for å la reaksjonsmekanismen fortsette. Følgende kjemiske ligning representerer ovennevnte:
Kan tjene deg: aluminiumhydrid (ALH3): struktur, egenskaper, brukRCOOH + R'OH RCOOR ' + H2ENTEN
(Sur halvparten)
Dette er kjent som forestring.
For eksempel kan fettsyrer esterifiserer med metanol, CHO3Å, for å erstatte syrene sine med metylgrupper, så denne reaksjonen kan også betraktes som metylering. Dette er et viktig trinn når du bestemmer fettsyreprofilen til visse oljer eller fett.
Esteres fra syreklorider
En annen måte å syntetisere estere på er fra acylklorider, rcocl. I dem, i stedet for å erstatte en OH -hydroksylgruppe, erstattes CL -atomet:
Rcocl + r'oh => rcoor ' + hcl
Og i motsetning til sterifisering av en karboksylsyre, frigjøres ikke vann, men saltsyre.
Andre metoder er tilgjengelige i verden av organisk kjemi, for eksempel oksidasjon av Baeyer-Villerer, som bruker peroksysyrer (RCOOOH).
Estres bruker
 Esteres brukes til forskjellige ting, for eksempel stearinlys
Esteres brukes til forskjellige ting, for eksempel stearinlys Blant hovedbruk av estere er:
- I utdypingslys eller stearinlys, for eksempel det overlegne bildet. For dette formål brukes veldig lange sidekjedestere.
- Som medisin konserveringsmidler eller mat. Dette skyldes virkningen av parabenene, som ikke er noe mer enn esterer av para-hydroxibenzoic acid. Selv om de beholder kvaliteten på produktet, er det studier som stiller spørsmål ved dens positive effekt på kroppen.
- De serverer for fremstilling av kunstige dufter som etterligner lukten og smaken av mange frukt eller blomster. Slik at estere er til stede i godbiter, iskrem, parfymer, kosmetikk, såper, sjampo, blant andre kommersielle produkter som fortjener aromaer eller attraktive smaker.
- Estere kan også gi en positiv farmakologisk effekt. Av denne grunn har legemiddelindustrien dedikert seg til å syntetisere estere avledet fra syrer som er til stede i kroppen for å evaluere enhver mulig forbedring i behandlingen av sykdommer. Aspirin er et av de enkleste eksemplene på disse estere.
- Flytende estere, som etylacetat, er tilstrekkelige løsningsmidler for visse typer polymerer, så som nitrocellulose og et bredt spekter av harpikser.
Eksempler på estere
Noen ekstra estere eksempler er følgende:
- Butanato de Pentilo, CH3Ch2Ch2Cooch2Ch2Ch2Ch2Ch3, som lukter som albicoque og pærer.
- Vinylacetat, Cho3Cooch2= Ch2, hvorfra polyvinylacetatpolymer oppstår.
- Isopentilo pentanoato, ch3Ch2Ch2Ch2Cooch2Ch2Ch (Ch3)2, som etterligner smaken av epler.
- Etylpropanoat, CH3Ch2Cooch2Ch3.
- Propylmetanoat, hcooch2Ch2Ch3.
Referanser
- T.W. Graham Solomons, Craight B. Yngel. Organisk kjemi. (Tiende utgave, s. 797-802, 820) Wiley Plus.
- Carey, f. TIL. Organic Chemistry (2006) Sjette utgave. Mc Graw Hill redaksjon-
- Kjemi librettexts. Nomenklatur av esers. Gjenopprettet fra: Chem.Librettexts.org
- Admin. (19. september 2015). Estere: dets kjemiske natur, egenskaper og bruk. Hentet fra: ren-kjemisk.com
- Organisk kjemi i vårt daglige liv. (9. mars 2014). Hva er bruken av estere? Hentet fra: Gen2ChemistAssignment.Weebly.com
- Kjemikk.Net (2018). Eksempler på estere. Gjenopprettet fra: Kjemikk.nett
- Paz María de Lourdes Cornejo Arteaga. Hovedapplikasjoner av estere. Hentet fra: uaeh.Edu.MX
- Jim Clark. (Januar 2016). Introduksjonsestere. Hentet fra: Chemguide.co.Storbritannia

