Progressivt sublimeringskonsept, prosess og eksempler
- 4785
- 812
- Thomas Karlsen
De Progressiv sublimering Det er en termodynamisk prosess der en endring av endotermisk tilstand skjer direkte fra et faststoff til en gass, uten forhåndsdannelse av væsken. Oppførselen til det faste stoffet under normale forhold er å varme og smelte; det vil si smelte. I mellomtiden begynner det faste stoffet å røyke direkte, uten det tidligere utseendet til dråper som indikerer dets støpte.
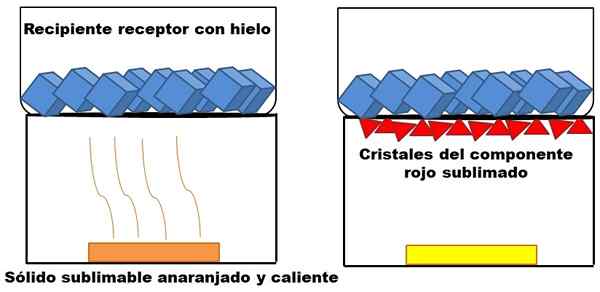
Det som er beskrevet i det øverste avsnittet er representert i det overordnede bildet. Anta at en oransje fast blanding (til venstre), som begynner å varme opp. Blandingen består av to komponenter eller faste stoffer: den ene gul og den andre røde, hvis kombinasjon forårsaker den oransje fargen.
 Eksempel på sublimering av et hypotetisk oransje fast stoff. Kilde: Gabriel Bolívar.
Eksempel på sublimering av et hypotetisk oransje fast stoff. Kilde: Gabriel Bolívar. Det sublimale røde faststoffet, siden det ikke dannes en væske av det, men ender opp med avsatt (røde trekanter) ved bunnen av den øvre beholderen; Den som inneholder isbiter, og tilbyr derfor en kald overflate. I mellomtiden forblir det gule faststoffet uendret av varme (gult rektangel).
Røde trekanter eller krystaller blir avsatt takket være den kalde overflaten av den mottakende beholderen (til høyre), som absorberer temperaturen; Og selv om det ikke er vist, må størrelsen på isbitene avta på grunn av varmeabsorpsjon. Det gule faststoffet er ikke sublimabelt, og hvis han fremdeles varmer opp før eller siden, vil han smelte.
[TOC]
Progressivt sublimeringskonsept
Prosess
Det har allerede blitt sagt at sublimering er en endotermisk tilstandsendring, for for det må det være varmeabsorpsjon. Hvis det faste absorberer varmen, vil energien øke, slik at partiklene også vil vibrere ved større frekvenser.
Når disse vibrasjonene blir veldig sterke, ender de opp med å påvirke intermolekylære interaksjoner (ikke kovalente bindinger); Og følgelig vil før eller senere partiklene ta flere avstander fra hverandre, til de klarer å flyte og bevege seg mer fritt gjennom romområdene.
Kan tjene deg: krystalliseringI noen faste stoffer er vibrasjonene så sterke, at noen partikler blir "utløst" utenfor strukturen i stedet for å agglomerere i mobile klynger som definerer en dråpe. Disse partiklene slipper unna og integrerer den første "boblen", som heller vil komme til å danne de første damper av det sublimerte faste stoffet.
Det snakkes da ikke om et smeltepunkt, men om en sublimering. Selv om begge er avhengige av det regjerende presset på det faste stoffet, er sublimeringspunktet mer; Derfor varierer temperaturen markant med trykkendringer (som tilfellet er med kokepunktet).
Fra den faste strukturen til gassforstyrrelse
I sublimering sies det også at det er en økning i systementropi. Partiklene til energitilstandene går fra å være begrenset av deres faste posisjoner i den faste strukturen, til å homogenisere seg i deres lunefulle og kaotiske retninger i gassformig tilstand, mer ensartet, der de til slutt skaffer seg en gjennomsnittlig kinetisk energi.
Fasediagram og trippelpunkt
Sublimeringspunktet avhenger av trykket; For ellers ville de faste partiklene absorbere varme for ikke å bli sparket til verdensrommet utenfor det faste stoffet, men for å danne dråper. Det ville ikke bli sublimert, men ville smelte eller smelte, som det er mest vanlig.
Jo større det ytre trykket, jo mindre sannsynlig vil sublimeringen være, siden det faste stoffet er forpliktet.
Men hvilke faste stoffer som er sublimable og hvilke som ikke gjør det? Svaret ligger i dine P vs T -fasediagrammer, som vist nedenfor:
Det kan tjene deg: Cruise for Crucible: Egenskaper, funksjoner, bruk eksempler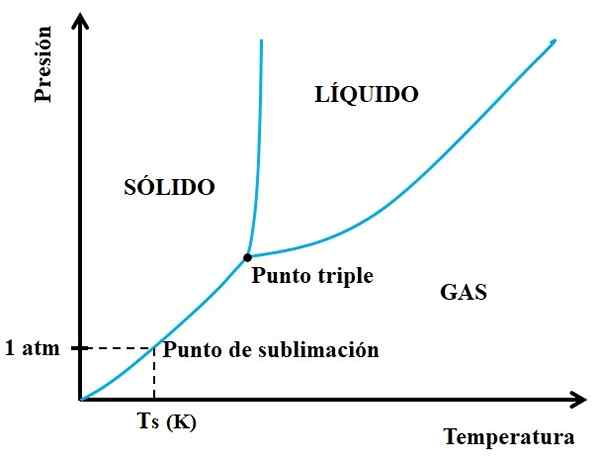 Fasediagram for et hypotetisk stoff. Kilde: Gabriel Bolívar.
Fasediagram for et hypotetisk stoff. Kilde: Gabriel Bolívar. Du må se først på trippelpunktet og reise den nedre strekningen: den som skiller de faste og gassformige tilstandene. Merk at det i det faste området må være en reduksjon i trykk slik at sublimering oppstår (ikke nødvendigvis 1 atmosfæretrykk). En 1 atm, det hypotetiske stoffet vil sublim vil ved en TS -temperatur uttrykt i K.
Jo lengre og lengre seksjon eller kurven under trippelpunktet, desto større er det faste stoffet til sublim ved forskjellige temperaturer; Men hvis det er godt under 1 atm, vil det være nødvendig med høye hull for å oppnå sublimering, slik at presset reduseres (for eksempel 0,0001 atm).
Forhold
Hvis trippelpunktet er tusenvis av ganger lavere enn atmosfæretrykket, vil faststoffet aldri sublimere eller til og med bruke ultra -liv (for ikke å nevne dets mottakelighet for å dekomponere ved virkningen av varme).
Hvis dette ikke er tilfelle, gjøres sublimeringene ved hjelp av moderat, og sender det faststoffet til vakuum slik at partiklene deres slipper lettere, uten behov for å absorbere så mye varme.
Sublimering blir veldig viktig når de er spesielt faste stoffer med høyt damptrykk; det vil si trykket inni, refleksjon av effektiviteten i interaksjonene. Jo større damptrykk, jo mer lukt er det, og også mer sublimable.
Eksempler
Fast rensing
Bildet av det oransje faststoffet og dets sublimable rødlige komponent er et eksempel på hva sublimering representerer angående fast rensing. Røde trekanter kan påvises så mange ganger som nødvendig til høy renhet er garantert.
Kan tjene deg: alkoholerDenne teknikken brukes hovedsakelig med velduftende faste stoffer. For eksempel: kamfer, koffein, benzoine og mentol.
Blant andre faste stoffer som kan underlever sublimering vi har: jod, is (i store høyder), teobromin (sjokolade), sakkarin, morfin og andre medisiner, nitrogenbaser og antracen.
Krystallsyntese
Tilbake til røde trekanter tilbyr sublimering et alternativ til konvensjonell krystallisering; Krystaller vil ikke lenger bli syntetisert fra en løsning, men ved måter.
La oss si at hvis de har røde firkanter, vil veksten av krystallene opprettholde denne geometrien og bør ikke bli trekantet. De røde rutene vil gradvis vokse etter hvert som sublimering finner sted. Imidlertid er det et operativt og molekylært kompleks kompleks, der mange involverte variabler blir sett.
Eksempler på syntetiserte krystaller via sublimering er: silisiumkarbid (SIC), grafitt, arsen, selen, fosfor, aluminium nitruro (ALN), kadmiumsulfid (CDS), sink seleniuro (Znse), Mercury Iodide (Hgi2), grafen, blant andre.
Merk at de virkelig er to kompilerte fenomener: progressiv sublimering og deponering (eller omvendt sublimering); Dampen emigrerer fra de faste til kaldere regioner eller overflater, for endelig å avsette i form av krystaller.
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Wikipedia. (2019). Sublimering (faseovergang). Hentet fra: i.Wikipedia.org
- Jones, Andrew Zimmerman. (27. januar 2019). Sublimering. Gjenopprettet fra: Thoughtco.com
- Sheila Morrissey. (2019). Hva er sublimering i kjemi? - Definisjon, prosess og eksamener. Studere. Gjenopprettet fra: Studie.com
- Elsevier f.V. (2019). Sublimeringsmetode. Scientedirect. Hentet fra: Scientedirect.com
- « Flogistteoriens opprinnelse, prinsipper og innvendinger
- Sosial dimensjon å være menneskelig, utdanning, kunnskap, rett, helse »

