Mangansulfat (MNSO4) struktur, egenskaper, innhenting, bruk

- 1127
- 147
- Oliver Christiansen
Han Mangansulfat (II) Det er et uorganisk fast stoff dannet av manganelementene (MN), svovel (er) og oksygen (O). Den kjemiske formelen er MSO4. Dens vannfri form (uten vann i strukturen) er et hvitt fast stoff. Imidlertid har den flere hydratiserte former, og alle er rosa faste stoffer.
Mangansulfat i veldig små (bittesmå) mengder brukes som mikronæringsstoff for både dyr og mennesker, siden det kreves for normal funksjon av organismen.
 Mangansulfat anhidro mnso4. YOSF0113 på engelsk Wikipedia / Public Domain. Kilde: Wikimedia Commons.
Mangansulfat anhidro mnso4. YOSF0113 på engelsk Wikipedia / Public Domain. Kilde: Wikimedia Commons. Det tilsettes også sammen med visse gjødsel i mangelfull jord i mangan (MN) for landbruksavlinger som trenger det, for eksempel drueplanter.
På grunn av den rosa fargen på dens hydratiserte varianter, brukes den i pigmenter som tjener til å male keramikk, fargeleggingsstoffer og andre materialer. Det tjener også til å oppnå andre manganforbindelser.
Mons4 må manipuleres nøye. Dets innånding kan forårsake luftveisproblemer og gi alvorlige ulemper i nervesystemet, som inkluderer symptomer som ligner på Parkinsons sykdom.
Overskuddet kan også forårsake skade på land og vannlevende dyr og planter.
[TOC]
Struktur
Vannfri mangansulfat (uten vann i sin krystallinske struktur) dannes av et manganion i oksidasjon +2, det vil si Mn2+ og en sulfatanion så42-.
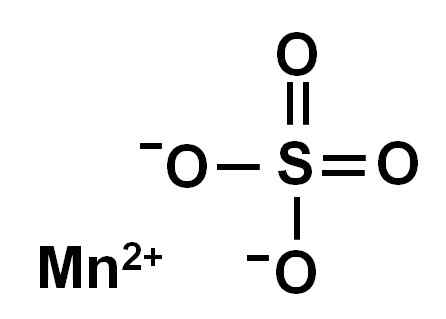 Kjemisk struktur av mangansulfat4. Forfatter: Marilú Stea.
Kjemisk struktur av mangansulfat4. Forfatter: Marilú Stea. Nomenklatur
- Mangansulfat (II)
- Mangan monosulfat
- Mangansulfat anhidro mnso4
- Mangan mangansulfat MSSO4 •H2ENTEN
- Tetrahydrat mangansulfat MSO4 •4H2ENTEN
- Mangansulfat pentahydrat4 •5H2ENTEN
- Hipthydrert mangansulfat4 •7H2ENTEN
Egenskaper
Fysisk tilstand
Mons4 vannfri (uten vann i strukturen) er et krystallinsk hvitt fast stoff. Hydratiserte varianter er imidlertid rosa eller blekrøde faste stoffer.
 Manganeso sulfat tetrahydrat mnso4.4H2Eller er et rosa fast stoff. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
Manganeso sulfat tetrahydrat mnso4.4H2Eller er et rosa fast stoff. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. Molekylær vekt
MSSO4 = 151 g/mol
MSSO4 •H2O = 169,02 g/mol
Smeltepunkt
Vannfri MSSO4 = 700 ºC
Monohydrat MSO4 •H2O = 400-450 ° C
Menso tetrahydrat4 •4H2O = 30 ° C
Kokepunkt
Vannfri MSSO4 = Den dekomponerer ved 850 ºC.
Det kan tjene deg: koboltklorid (COCL2 (: Struktur, nomenklatur, egenskaperMenso tetrahydrat4 •4H2O = 850 ° C
Tetthet
MSSO4 = 3,25 g/cm3
MSSO4 •H2O = 2,95 g/cm3
Løselighet
Veldig løselig i vann: 52 g/100 ml vann ved 5 ° C. Alkoholoppløselig. Uoppløselig i eter. Litt løselig i metanol.
Ph
En monse -løsning4 •H2Eller 5% har en pH på 3,7.
Kjemiske egenskaper
Når man oppløses i vann, skilles MNSO4 i Mn -ionene2+ Og så42-.
Manganionen (ii) mn2+ I syre eller nøytral løsning er det knyttet til 6 vannmolekyler2Eller danner heksaacuomangansk ion [Mn (h2ENTEN)6]2+, som er rosa.
Det heksaacuomanganske ionet [Mn (h2ENTEN)6]2+ Det er ganske motstandsdyktig mot oksidasjon. I basisk medium (alkalisk pH) blir dette ionet manganhydroksyd (II) Mn (OH)2, som lett oksideres, og danner manganforbindelser (III) og mangan (IV).
 MSSO -løsninger4 Syrer er rosa ved tilstedeværelsen av det heksaacuomanganske ionet [Mn (H2ENTEN)6]2+. Forfatter: Steve Cross. Kilde: Pixabay.Mangansulfat har flere hydratiserte former, det vil si med vann h2Eller i sin krystallinske struktur.
MSSO -løsninger4 Syrer er rosa ved tilstedeværelsen av det heksaacuomanganske ionet [Mn (H2ENTEN)6]2+. Forfatter: Steve Cross. Kilde: Pixabay.Mangansulfat har flere hydratiserte former, det vil si med vann h2Eller i sin krystallinske struktur.
Dette er monohydrat MSO4 •H2Eller, tetrahydrat MSO4 •4H2Eller, mnse pentahydrat4 •5H2O og hepthydrat MSO4 •7H2ENTEN. Disse hydratiserte formene inneholder det heksaacuomanganske ionet [Mn (H2ENTEN)6]2+ I krystaller og av denne grunn er de rosa faste stoffer.
Monohydratet Menso4 •H2Eller den er litt florescerende, noe som betyr at det mister noe av fuktighetsvannet sakte når det blir utsatt for miljøet.
Å skaffe
Mons4 kan oppnås ved å behandle manganoksid (II) MNO, Mn Manghanous hydroxide (OH)2 o mangan karbonat (ii) mnco3 Med svovelsyre H2SW4.
MNCO3 + H2SW4 → MSSO4 + H2Eller + co2
applikasjoner
Som et ernæringsmessig komplement
Mangansulfat i små mengder serverer visse funksjoner i menneskekroppen og dyrene.
Det er derfor det er viktig som en nyttig forbindelse i ernæring og leveres som et mattilskudd. Det brukes i spor (ekstremt små mengder).
Høye mengder kan være veldig giftige og skadelige.
I veterinærmedisin
Mons4 Korralfugler (kyllinger, kalkuner, ender og phaisanes) administreres for å forhindre mangel eller mangel på manganelement hos disse dyrene.
Kan tjene deg: kaliumjodat (kio3)Manganmangel er manifestert i dem, for eksempel som sykdommen som kalles perose, som er deformasjonen av beinene til unge fugleben.
 Patitos kan kreve monste -spor4 I kostholdet for å forhindre perose. Forfattere: s. Hermann & F. Richter. Kilde: Pixabay.
Patitos kan kreve monste -spor4 I kostholdet for å forhindre perose. Forfattere: s. Hermann & F. Richter. Kilde: Pixabay. Det gjelder fôring av disse fuglene i veldig små mengder eller spor.
I landbruket
Mangansulfat brukes som mikronæringsstoff i gjødsel for vinstokker (drueplanter) og tobakksplantasjer i mangelfulle stiger i mangan.
Noen studier indikerer imidlertid at overflødig mangansulfat kan hemme eller redusere dannelsen av visse viktige enzymer for vekst av planter og deres utbrudd.
 I noen tilfeller bruker det MNSO4 til bakken der drueplanter er. Forfatter: Schwoaze. Kilde: Pixabay.
I noen tilfeller bruker det MNSO4 til bakken der drueplanter er. Forfatter: Schwoaze. Kilde: Pixabay. For eksempel har det blitt funnet at det er giftig for noen avlinger som bomull.
Mons4 Den har også bruk i soppdrepende midler, og sammen med visse organiske forbindelser er en del av visse plantevernmidler.
I flere applikasjoner
Mons4 Hydrert brukes av fargelegging for å tilberede uorganiske pigmenter som brukes i rød lakk for keramikk, i stoffer og andre materialfargestoffer.
Mangansulfat brukes i glassproduksjon og såper tilberedes også med den.
 Noen keramiske fliser kan inneholde mangansulfatpigmenter. Forfatter: Dwilliams. Kilde: Pixabay.
Noen keramiske fliser kan inneholde mangansulfatpigmenter. Forfatter: Dwilliams. Kilde: Pixabay. Mons4 Det er startmaterialet for å oppnå manganmetall (MN) elektrolytisk, det vil si ved å bruke strøm på vandige oppløsninger.
Det lar deg også skaffe mangandioksid2 og mangan karbonat3.
Mons4 Det brukes også til kjemisk analyse og i formulering av løsninger brukt i genetiske eksperimenter med mikroorganismer.
Risiko
Mangansulfat inneholder manganion (II) (MN2+), som kan være både ufarlig og giftig avhengig av mengdene personen, dyret eller planten blir utsatt.
Mangan er viktig for normal funksjon av organismen til mennesker, dyr og noen planter. Men dessverre er mangan også nevrotoksisk, det vil si at det påvirker nervesystemet og noen plantefunksjoner.
Kan tjene deg: som designet det første moderne termometeret?Tilsynelatende trygge beløp
Mons4 Administrert med matformet mat (ekstremt små eller bittesmå mengder) er generelt trygt ved administrering av mat og medisiner, eller FDA (forkortelse for engelsk Food and Drug Administration).
Farlige beløp
Langvarig eller gjentatt eksponering for denne forbindelsen i betydelige mengder kan skade mennesket og dyrene.
Det gir irritasjon i slimhinnene og slimhinnene i luftveiene, anoreksi, hodepine, tap av balanse, lungebetennelse og luftveisinfeksjoner.
Kronisk innånding forårsaker skade på nervesystemet, og genererer manghanisme, skjelving i typiske hender og symptomer på Parkinsons sykdom.
 Mangansulfat påvirker nervesystemet. Forfatter: Sabine Zierer. Kilde: Pixabay.
Mangansulfat påvirker nervesystemet. Forfatter: Sabine Zierer. Kilde: Pixabay. Derfor bør spredningen av MSO -støv unngås4, Bruk pusteutstyr og vernehansker.
Det er giftig for vannlevende liv, og i dette genererer jeg langsiktige effekter. Det må lagres på steder der det ikke er tilgang til drenering eller kloakksystem. Det er veldig viktig å ikke la det bli kastet i miljøet.
Referanser
- ELLER.S. National Library of Medicine. (2019). Sulfat mangan. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Ullmanns Encyclopedia of Industrial Chemistry. (1990). Femte utgave. Volum A22. VCH Verlagsgellschaft MBH.
- ELLER.S. National Library of Medicine. (2019). Mangansulfatmonohydrat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Dunham, m.J. (2010). Guide to Yast Genetics: Functional Genomics, Proteomics og annen systemanalyse. Medium formulering. I metoder i enzymologi. Gjenopprettet fra Scientedirect.com.
- Saric, m. og Lucchini, r. (2007). Mangan. Du bruker. I håndbok om toksikologien til metaller (tredje utgave). Gjenopprettet fra Scientedirect.com.
- Vallero, d. (2014). Nevrologiske effekter av luftpolutanter. Mangan. I Funds of Air Pollution (Femte utgave). Gjenopprettet fra Scientedirect.com.
- Chee, r. (1986). In vitro Kultur av Vitis: Effektene av lysspektrumsmangansulfat og kaliumjodid på morfogenese. Plantecelle, tiss og organkult 7: 121-134 (1986). Lenke gjenopprettet.Springer.com.

