Kvantetabell
- 1249
- 56
- Daniel Skuterud
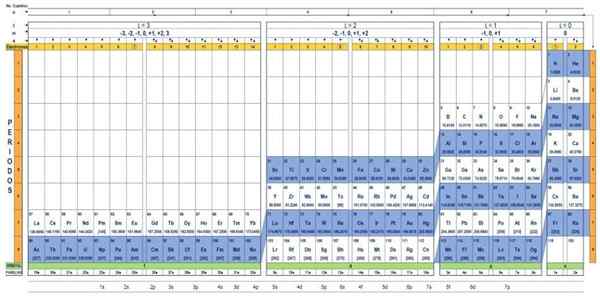
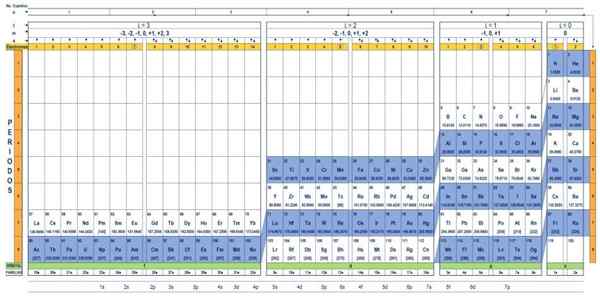 Kvantetabellen til elementene. Kilde: UNAM.
Kvantetabellen til elementene. Kilde: UNAM. Hva er kvantetabellen?
De Kvantetabell Det er en måte å organisere de kjemiske elementene, designet for å enkelt bestemme settet med kvantetall som kjennetegner hver av dem.
Forskere har funnet ut at det i form av alle elementer er visse mønstre. Blant disse mønstrene er kvantetall, fire enkle tall som beskriver den elektroniske konfigurasjonen til hvert element.
Kvantetall oppstår naturlig fra den mekaniske mekaniske modellen til atomet og er betegnet med bokstaver: n, ℓ, mℓ og s. De beskriver energistatusen til elektroner i atomet til hvert kjemisk element.
Gjennom den tradisjonelle periodiske tabellen, og noen ekstra verktøy, er det mulig å ha den elektroniske konfigurasjonen av atomet til et hvilket som helst element. Fordelen med kvantetabellen er at elementene er organisert på en slik måte at kvantetallene deres umiddelbart er synlige, uten behov for å gjøre mange beregninger separat.
Kjennetegn på kvantetabellen
Det er flere kvantetabeller design. Modellen vist på figuren over inneholder:
- En overskrift med fire rader, med verdiene til de fire kvantetall.
- Bodens kropp, som består av et rutenett som inneholder symbolet på det kjemiske elementet, som starter med hydrogenet, i den nest siste kolonnen til høyre, etterfulgt av helium, og så videre. Antallet nedenfor representerer mengden atomelektroner i en grunnleggende tilstand.
- Nederst i den grønne raden er det fire klasser for å organisere elementene: orbitalene S, P, D og F (fra venstre til høyre).
- Til slutt, under den orbitale raden er familien. Hver kolonne er en familie, nummerert fra 1 til 32. For eksempel tilhører 1. og 2. familier S -klassen, familier fra 3. til 8A, tilhører klasse P, og så videre.
Hva er kvantetabellen for?
Kvantetabellen tjener til å finne settet med kvantetall som kjennetegner et elektron fra atomet. Normalt vil disse elektronene være de i det ytterste laget, siden det er de som definerer elementets kjemiske oppførsel.
Hvordan er kvantetabellen?
Kvantetabellen gjør det enkelt å finne kvantetallene til elektronene i det ytterste laget av atomet.
Eksempel 1
For å illustrere prosedyren blir aluminiumselementet tatt som et eksempel, hvis symbol er for. Det første trinnet er å lokalisere det i kvantetabellen, og markere det med en Rød sirkel:
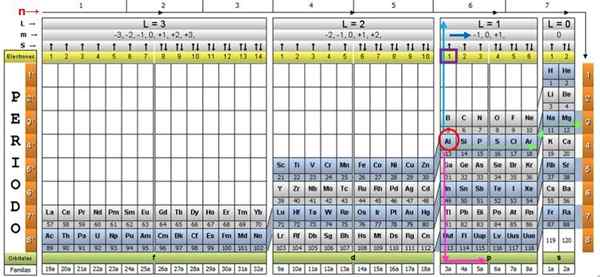
Trinn 1: Finn n
Etter å ha lokalisert elementet i tabellen, må du bevege deg gjennom den samme raden og fargen, til høyre, til du kommer til den oransje kolonnen, etter veien til den grønne pilen vist på bildet.
Pilen peker på den markerte boksen med nummer 3, som er det viktigste kvantetallet n:
n = 3
Trinn 2: Finn ℓ
For å bestemme det sekundære kvantetallet følges den blå vertikale pilen, noe som indikerer:
ℓ = 1.
Trinn 3: Finn m
Det ytre aluminiumelektronet finnes i Pubilling P -familien, som det kan leses i den grønne raden, som den rosa pilen peker.
I tillegg blir mengden elektroner i det siste laget lest i den gule raden i overskriften. Når det gjelder aluminium er det 1 elektron (uthevet i den lilla firkanten), som er referansen. Ved å kombinere resultatene ovenfor, er konfigurasjonen av det siste laget:
Kan tjene deg: galvanisk celle: deler, hvordan fungerer, applikasjoner, eksempler3p1
Det er kjent at et P -lag støtter maksimalt 6 elektroner. Og tallet M tar noen av hele verdiene - ℓ, ( - ℓ+1), ... 0, ... (+ℓ −1),+ℓ.
Som i dette tilfellet ℓ = 1, kan M være −1, 0, 1.
Disse tallene vises i raden til overskriften som tilsvarer M (se på bildet Horisontal pil blå). Følgende tabell fungerer som en guide for å vite hva som er verdien av å velge, avhengig av saken:
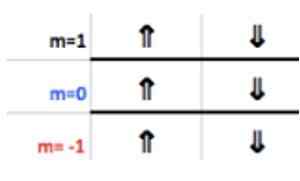
Siden det siste aluminiumslaget har 1 elektron, tilsvarer magnetisk kvantetall
m = 1.
Trinn 4: Finn s
Spinnnummeret s har bare to verdier: +½ eller - ½. I toppboksen, hvis pilen indikerer opp, er den valgt S = +½, og hvis den peker ned, så er S = - ½. Når det gjelder aluminium, peker elektron 1 opp, derfor:
S = + ½.
Kort sagt, kvantetallene til elektronet til det ytterste aluminiums lag til lyden:
n = 3; ℓ = 1; M = 1, s = +½
Eksempel 2 (Eksepsjonelle tilfeller)
Sølv AG, og omtrent tjue flere elementer, er eksepsjonelle tilfeller, så det må tas forsiktighet når du bruker kvantetabellen med dem.
Hvis den forrige prosedyren gjentas, vil AG bli oppnådd som et siste undernivå på 4D9.
Dette er fordi den forutsagte konfigurasjonen av La Plata, etter Madelungs regel, er:
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s2 4d9
I praksis følger AG imidlertid ikke denne konfigurasjonen nøyaktig, og heller ikke andre elementer hvis siste forutsagte lag er 4D9, for eksempel kobber og gull, blant andre (konsulter Internett for å få en komplett liste over elementer som ikke følger Madelungs regel).
Kan tjene deg: MolealityDen virkelige konfigurasjonen av AG er:
1s2 2s2 2 s6 3s2 3p6 4s2 3d10 4p6 5s1 4d10
Der et elektron av 5S -laget2 hoppet til 4D -laget9 for å fullføre det. På denne måten øker atomets stabilitet. Derfor er den siste undernivået virkelig:
5s1
Og kvantetallene vil være de som tilsvarer RB -elementet, vist i en lilla boks, med oransje piler som peker på de gjenværende tallene:
n = 5; ℓ = 0; m = 0; S = +½
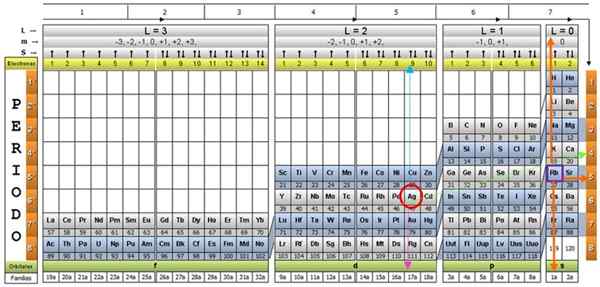 Gjennomgang av den periodiske tabellen, ser det faktisk at AG er i periode 5, en karakteristikk bestemt av hovedkvantumnummeret n.
Gjennomgang av den periodiske tabellen, ser det faktisk at AG er i periode 5, en karakteristikk bestemt av hovedkvantumnummeret n.
Forskjeller med den periodiske tabellen
Begge tabellene er to måter å organisere de kjemiske elementene i henhold til egenskapene til atomene deres:
-I den periodiske tabellen har elementene som er funnet i samme kolonne lignende kjemiske egenskaper. For eksempel begynner det med den alkaliske metallsøylen til venstre og slutter den av edle gasser til høyre. Mens i rekkene er elementene med samme høyere energinivå.
-Kvantetabellen har en trappet disposisjon, designet i henhold til fyllingsreglene. Derfor må du følge trinnene for å skaffe hovedkvantetallet, bortsett fra i tilfelle unntak som sølv, i eksemplet fra forrige seksjon. Familiene til elementer i denne tabellen er relatert gjennom øvre orbital, i S, P, D eller F.
Referanser
- Chang, R. 2013. Kjemi. 11va. Utgave. McGraw Hill Education.
- Elektronisk konfigurasjon. Elektronisk konfigurasjon og kvantetall. Hentet fra: Configuionectronica.com.
- Kjemisk håndbok. Hentet fra: DCB.Ingeniørfag.Unam.MX.
- Offisiell kjemi. Hvordan enkelt kvantetall enkelt. Hentet fra: Chemistry Official.com
- Triplenlace. Unntak fra Madelungs styre i den elektroniske konfigurasjonen av kjemiske elementer. Hentet fra: Triplenlace.com.

