Periodisk elementer
- 1473
- 344
- Markus Fredriksen
Hva er den periodiske tabellen over elementene?
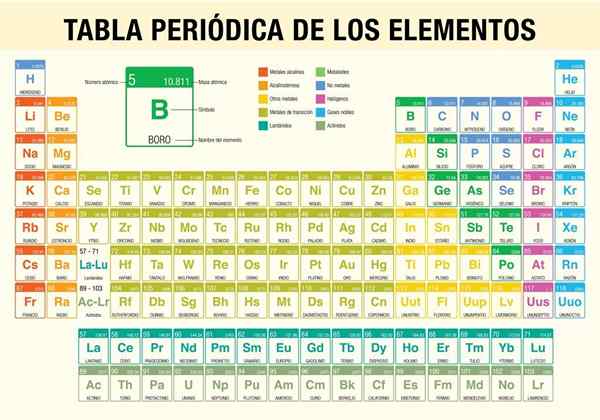
De Periodisk elementer Det er et verktøy som lar deg konsultere de kjemiske egenskapene til de 118 elementene som hittil er kjent. Det er uunnværlig når du utfører støkiometriske beregninger, forutsier de fysiske egenskapene til et element, klassifiserer dem og finner periodiske egenskaper blant dem alle.
Atomer blir tyngre etter hvert som kjernene deres tilfører protoner og nøytroner, som også må ledsages av nye elektroner; Ellers ville ikke elektroneutralitet være mulig. Dermed er noen atomer veldig lette, for eksempel hydrogen og andre, superpesados, som Oganerson.
Det var forskeren Dmitri Mendeléyev, som i 1869 (for nesten 150 år siden) publiserte, etter et tiår med teoretiske studier og eksperimenter, den første periodiske tabellen i et forsøk på å organisere de 62 elementene som er kjent på den tiden.
Hva er det periodiske bordet for?
Hovedbruk av bordet er:
- Kjenn symbolet og navnet på hvert kjemisk element som eksisterer.
- Kjenn atommassen og atomnummeret til elementet.
- Informere om forholdene mellom de forskjellige elementene.
- Vis de forskjellige trendene (periodisitet).
- Klassifisering av typer kjemiske elementer. Disse typene inkluderer alkaliske metaller, basiske metaller, overgangsmetaller, ikke -metaller, edle gasser, halogener, alkaliske land, semimetaler, aktinider og lantanider.
- Forutsi egenskapene til nye elementer som ennå ikke er oppdaget eller ikke syntetisert.
Hvordan er det periodiske bordet organisert? (Struktur og organisering)
Perioder
Elementene er bestilt i rader eller perioder avhengig av energinivået til orbitaler. Før periode 4, da elementene fulgte i økende rekkefølge av atommassen, var det at for hver åtte av dem ble de kjemiske egenskapene gjentatt igjen (loven til Octaves, av John Newlands).
Overgangsmetaller snek seg til andre ikke -metalliske elementer, for eksempel svovel og fosfor. Av denne grunn var inntreden av kvantefysikk og elektroniske konfigurasjoner for forståelsen av moderne periodiske tabeller viktig.
Orbitalene til et energisjikt er fylt med elektroner (og kjernene til protoner og nøytroner), da det beveger seg over en periode. Dette energilaget går hånd i hånd med atomstørrelse eller radio; Derfor er elementene i de høyere periodene mindre enn de som er funnet nedenfor.
H og jeg har funnet i den første (perioden) energinivået; den første raden med grå bokser, i fjerde periode; og raden med Ananjadas -bokser, i sjette periode. Legg merke til at selv om sistnevnte ser ut til å være i den påståtte niende perioden, tilhører den faktisk den sjette, like etter den gule boksen med BA.
Grupper
Turnering av en periode er at massen, antall protoner og elektroner øker. I samme kolonne eller gruppe, selv om massen og protonene varierer, var antallet av antall Valencia Layer elektroner er lik.
For eksempel i den første kolonnen eller gruppen har H bare ett elektron i 1s orbital1, Som Li (2s1), Natrium (3s1), Kalium (4s1) Og så videre til Francio (7s1). At nummer 1 betegner at disse elementene knapt har et Valencia -elektron, og derfor tilhører gruppe 1 (AI). Hvert element er i forskjellige perioder.
Uten å telle hydrogen, grønn boks, er elementene under den fra oransje bokser og kalles alkaliske metaller. En til til høyre boks i en hvilken som helst periode, er gruppen eller kolonnen 2; det vil si at elementene har to valenselektroner.
Kan tjene deg: teoretisk ytelseMen når du går til høyre, uten kunnskap om orbitalene d, når du Boro (b) eller gruppe 13 (iiia) -gruppen; I stedet for gruppe 3 (iiib) eller Scandio (SC). Når man tar hensyn til fylling av orbitaler d, begynner periodene med de grå boksene å bli reist: overgangsmetallene.
Protoner tall vs elektroner i Valencia
Når du studerer den periodiske tabellen, kan det oppstå forvirring mellom atomnummeret z eller antall totale protoner i kjernen, og mengden valenselektroner. For eksempel har karbon en z = 6, det vil si at den har seks protoner og derfor seks elektroner (ellers kunne det ikke være et atom med nøytral belastning).
Men av de seks elektronene, Fire er fra Valencia. Av den grunn er den elektroniske konfigurasjonen [han] 2s22 s2. [Han] betegner de to elektronene 1s2 av det lukkede laget, og teoretisk sett ikke deltar i dannelsen av kjemiske koblinger.
Fordi karbon har fire valenselektroner, er "praktisk" lokalisert i gruppe 14 (mva) av det periodiske tabellen.
Elementene under karbon (ja, GE, SN, Pb og FL) har flere høyere atomiske (og atomiske) tall; Men alle har til felles de fire elektronene i Valencia. Dette er nøkkelen til forståelsen av hvorfor et element tilhører en gruppe og ikke en annen.
Elementer i det periodiske bordet
Blokk s
Som forklart er gruppe 1 og 2 preget av å ha en eller to elektroner i orbitaler. Disse orbitalene er sfæriske geometri, og ettersom noen av disse gruppene er avstammet, skaffer elementene seg lag som øker størrelsen på atomene.
For å presentere sterke trender i sine kjemiske egenskaper og måter å reagere på, er disse elementene organisert som blokkering S. Derfor tilhører alkaliske metaller og alkalinerimetaller til denne blokken. Den elektroniske konfigurasjonen av elementene i denne blokken er NS (1s, 2s osv.).
Selv om heliumelementet er øverst til høyre for tabellen, er det elektroniske konfigurasjonen 1s2 Og tilhører derfor denne blokken.
Blokk s
I motsetning til blokkering S, presenterer elementene i denne blokken helt fulle orbitaler, mens deres p -orbitaler fortsetter å fylle med elektroner. De elektroniske konfigurasjonene av elementene som tilhører denne blokken er av NS -typen2Np1-6 (P orbitals kan ha en eller opptil seks elektroner å fylle).
Så i hvilken del av det periodiske tabellen er denne blokken? Til høyre: De grønne, boligene og blå bokser; Det vil si ikke -metalliske elementer og tungmetaller, som vismut (BI) og bly (PB).
Starter med bor, med NS elektronisk konfigurasjon2Np1, Karbon på høyre side legger til et annet elektron: 2s22 s2. Deretter er de elektroniske konfigurasjonene av de andre elementene i periode 2 i blokk P: 2s22 s3 (nitrogen), 2s22 s4 (oksygen), 2s22 s5 (Fluor) og 2s22 s6 (neon).
Hvis de lavere periodene senkes, vil energinivået 3: 3S ha23p1-6, Og så videre til slutten av blokken P.
Legg merke til at det viktigste i denne blokken er at elementene fra periode 4 har fullstendig fylte orbitaler (blå bokser og fremover til høyre). Oppsummert: S -blokken er til venstre for det periodiske tabellen, og blokkering P, til høyre.
Representative elementer
Hva er de representative elementene? De er de som på den ene siden lett mister elektroner, eller på den andre, de vinner dem for å fullføre oktetten av Valencia. Med andre ord: de er elementene i blokker S og P.
Kan tjene deg: Emulgator: Emulsjonsprosess, molekylære aspekter, applikasjonerGruppene deres skilte seg fra andre ved hjelp av et brev A på slutten. Dermed var det åtte grupper: fra AI til viiia. Men for øyeblikket er nummereringssystemet som brukes i moderne periodiske tabeller arabisk, fra 1 til 18, inkludert overgangsmetaller.
Av den grunn kan Boro -gruppen være IIIA, eller 13 (3+10); karbongruppen, mva eller 14; og den av edle gasser, den siste til høyre for bordet, viiia eller 18.
Overgangsmetaller
Overgangsmetaller er alle elementene i de grå boksene. Gjennom sine perioder er orbitaler fylt, som er fem og kan derfor ha ti elektroner. Ettersom ti elektroner må fylle ut orbitaler, må det være ti grupper eller kolonner.
Hver av disse gruppene i det gamle nummereringssystemet ble utpekt med romertall og en bokstav B på slutten. Den første gruppen, den av Scandio, var IIIB (3), jernet, kobolt og nikkel VIIIB for å ha veldig like reaktiviteter (8, 9 og 10), og den fra sink IIB (12).
Som det kan sees, er det mye lettere å gjenkjenne grupper etter arabiske tall enn å bruke romertall.
Intern overgangsmetaller
Fra periode 6 i det periodiske bordet begynner orbitaler f å være energisk tilgjengelig. Disse må fylles først enn orbitalene d; Og derfor er elementene vanligvis plassert fra hverandre for ikke å forlenge bordet for mye.
De to siste periodene, oransje og gråaktig. Det er syv orbitaler f, som trenger fjorten elektroner for å fylle, og derfor må det være fjorten grupper.
Hvis disse gruppene blir lagt til den periodiske tabellen, vil det være 32 totalt (18 + 14) og vil ha en "langstrakt" versjon:
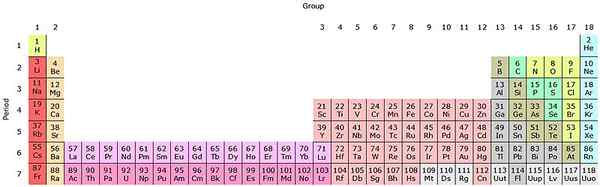 Kilde: av Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons
Kilde: av Sandbh [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)], fra Wikimedia Commons Den klare rosa raden tilsvarer Lantanoides, mens den mørkrosa raden aktinoidene. Lantano, med Z = 57, Actinio, AC med Z = 89, og hele blokken F tilhører den samme gruppen av Scandio. Fordi? Fordi Scandio har en ND -orbital1, som er til stede i resten av lantanoidene og aktinoider.
Og AC har 5D Valencia -innstillinger16s2 og 6d17s2. Når du beveger deg rett på begge radene, begynner 4F og 5F orbitaler å fylle. Når du er full, når du elementene Luthacio, Lu og Laurencio, LR.
Metaller og ikke -metaller
Etterlater kaken til det periodiske bordet, er det mer praktisk å ty til det overlegne bildet, selv i sin langstrakte form. For øyeblikket har det store flertallet av de nevnte elementene vært metaller.
Ved romtemperatur er alle metaller faste stoffer (unntatt kvikksølv, som er væske) av sølvgrå (bortsett fra kobber og gull). De er også vanligvis harde og strålende; Selv om blokkeringen er myke og skjøre. Disse elementene er preget av deres enkle å miste elektroner og danne kationer m+.
Når det gjelder lantanoidene, mister de tre elektronene 5D16s2 Å bli trivalente kationer m3+ (som henne3+). Bakken er i mellomtiden i stand til å miste fire elektroner (CE4+).
På den annen side utgjør ikke -metalliske elementer den minste delen av det periodiske bordet. De er gasser eller faste stoffer med kovalent koblede atomer (som svovel og fosfor). Alle er lokalisert i blokk P; Mer presist, i den øvre delen av den, ettersom det synker ned til de nedre periodene øker den metalliske karakteren (BI, PB, PO).
I tillegg vinner ikke -metaller i stedet for å miste elektroner, dem. Dermed danner de anioner x- Med forskjellige negative belastninger: -1 for halogener (gruppe 17) og -2 for kalsogener (gruppe 16, oksygen).
Kan tjene deg: etylalkohol: struktur, egenskaper, bruk, skaffeMetallfamilier
Innen metaller er det en intern klassifisering for å skille dem fra:
- Gruppe 1 metaller er alkalisk.
- Gruppe 2, alkalinerrior metaller (SR. Scholambara).
- Gruppe 3 (IIB) Scandio -familien. Denne familien består av Scandio, Group Head, av ititrium og, av Lantano, Actinio, og alle Lantanoides og Actinoides.
- Gruppe 4 (IVB), Titanium Family: Ti, Zr (Circonium), HF (Hafnio) og RF (Rutherfordio). Hvor mange Valencia -elektroner har? Svaret er i gruppen din.
- Gruppe 5 (VB), Vanadio Family. Gruppe 6 (vib), kromfamilie. Og så videre til sinkfamilien, gruppe 12 (IIB).
Metalloider
Den metalliske karakteren øker fra høyre til venstre, og fra topp til bunn. Men hva er grensen mellom disse to typene kjemiske elementer? Denne grensen består av elementer kjent som metalloider, som har kjennetegn ved både metaller og ikke -metaller.
Metalloider kan sees i det periodiske tabellen i "trappen" som begynner med bor, og slutter i det Astato radioaktive elementet. Disse elementene er:
- B: Boro.
- Silisium: Ja.
- GE: Germanio.
- AS: Arsen.
- SB: Antimon.
- TE: Telurio.
- AT: Astato.
Hvert av disse syv elementene viser mellomegenskaper, som varierer i henhold til det kjemiske miljøet eller temperaturen. En av disse egenskapene er halvledning, det vil si metalloider er halvledere.
Gasser
Under terrestriske forhold er gassformige elementer de ikke -lysetallene, for eksempel nitrogen, oksygen og fluor. Også klor, hydrogen og edle gasser går inn i denne klassifiseringen. Av dem alle er de mest emblematiske de edle gassene, for deres lave tendens til å reagere og oppføre seg som frie atomer.
Sistnevnte finnes i gruppe 18 av det periodiske tabellen og er:
- Helio, han.
- Neon, ne.
- Argon, ar.
- Kripton, Kr.
- Xenón, xe.
- Radón, Rn.
- Og den siste av alle, den edle syntetiske Oganesiske gassen, OG.
Alle edle gasser har til felles Valencia NS -konfigurasjonen2Np6; det vil si at de har fullført oktet av Valencia.
Aggregering sier til andre temperaturer
Elementene er i fast, flytende eller gassformig tilstand, avhengig av temperaturen og styrken til interaksjonene deres. Hvis jordens temperatur kjøler til den absolutte null (0K) er rundt, ville alle elementene fryse; Bortsett fra helium, noe som ville kondensere.
Ved denne ekstreme temperaturen ville resten av gassene være i form av is.
På det andre ytterpunktet, hvis temperaturen var omtrent 6000K, ville "alle" elementene være i gassformig tilstand. Under disse forholdene kunne skyer av gull, sølv, bly og andre metaller bokstavelig talt observert.
Viktigheten av det periodiske bordet
For øyeblikket er den periodiske tabellen det viktigste organisasjonsinstrumentet for kjemi på grunn av de detaljerte forholdene til elementene. Bruk.
Med bare å se på den periodiske tabellen, oppnås en enorm mengde og informasjon raskt og effektivt, for eksempel:
- Litium (Li), Beryllium (BE) og Bor (B) Gjennomfører strøm.
- Litium er et alkalisk metall, Beryllium er et alkalinalt metall og bor er ikke noe metall.
- Litium er den beste driveren av de tre nevnte, etterfulgt av Beryllium og til slutt Boron (halvleder).
Ved å lokalisere disse elementene i den periodiske tabellen, kan dens tendens til elektrisk ledningsevne øyeblikkelig konkluderes.