Typer batterier, egenskaper og reaksjoner

- 4801
- 14
- Jonathan Moe
I markedet kan du bli annerledes Typer batterier med hennes karakteristikker egen. Batteriene, som ikke er annet enn voltaiske celler, gir forbrukeren fordelen av å ta med noe sted (forutsatt at forholdene ikke er drastiske).
Generelt kan batterier kjøpes isolerte; Men de er også festet til hverandre i serie eller parallelt, hvis sett er det de kaller batterier. Og noen ganger brukes begrepene 'batterier' og 'batterier' vanligvis ubetinget, selv om de ikke er de samme.
 Alkaliske batterier: En av de mest kjente typene batterier
Alkaliske batterier: En av de mest kjente typene batterier Batteriene kan ha utallige farger, former og størrelser, som det kan lages av andre materialer. Også, og enda viktigere, deres interne struktur, der kjemiske reaksjoner som genererer strøm utvikles, tjener til å skille dem fra hverandre.
For eksempel vises tre alkaliske batterier, en av de vanligste i det øvre bildet. Begrepet alkalisk refererer til det faktum at mediet der frigjøringen og strømmen av elektroner oppstår er grunnleggende; det vil si at den har en pH større enn 7 og OH -anionene dominerer- og andre negative kostnader.
[TOC]
Pilas klassifisering
Før du tar opp noen av de forskjellige typer batterier, er det nødvendig å vite at disse er klassifisert globalt som primære eller sekundære.
- Primære batterier
Primære batterier er de som en gang konsumeres, må kastes eller resirkuleres, siden den kjemiske reaksjonen som den elektriske strømmen opprettholdes er irreversibel. Derfor kan disse ikke lades opp.
De brukes hovedsakelig i applikasjoner der det er upraktisk å lade opp elektrisk energi; slik som på militære enheter, midt på slagmarken. De er også designet for utstyr som bruker lite energi, slik at de varer lenger; For eksempel fjernkontroller eller bærbare konsoller (Gameboy, Tetris og Tamagotchi).
Alkaliske batterier, for å sitere et annet eksempel, tilhører også den primære typen. De har vanligvis sylindriske former, selv om dette ikke innebærer at sylindriske batterier ikke kan være sekundære eller opplades.
- Sekundære batterier
I motsetning til primære batterier, kan sekundære lades når de har gått tom for energi.
Dette er fordi de kjemiske reaksjonene som oppstår i dem er reversible, og derfor, etter å ha påført en viss spenning, får det produktarten til å bli reagens igjen, for å starte reaksjonen igjen.
Noen sekundære batterier (kalt batterier) er vanligvis små, som primære; Imidlertid blir de tildelt enheter som bruker mer energi og som bruk av primærbatterier vil være økonomisk og energisk. For eksempel inneholder mobiltelefoner batterier sekundære batterier.
Sekundære batterier er også designet for stort utstyr eller kretsløp; For eksempel bilbatterier, som er sammensatt av flere batterier eller voltaiske celler.
De er vanligvis dyrere enn primære batterier og batterier, men for langvarig bruk ender de opp med å være et mer passende og effektivt alternativ.
- Andre aspekter
Batteriene er klassifisert enten i primær eller sekundær; Men kommersielt eller populært er de vanligvis klassifisert i henhold til formen (sylindriske, rektangulære, knapper), til enheten som er bestemt (kameraer, kjøretøy, kalkulatorer), til navnene deres (AA, AAA, C, D, N, A23, etc. .), Og til IEC- og ANSI -kodene.
Det kan tjene deg: pyridin: struktur, egenskaper, bruk, toksisitet, synteseKarakteristikker som spenningen (1,2 til 12 volt), så vel som deres levetid og priser, er også ansvarlig for å gi en viss klassifisering i forbrukerens øyne.
Halpyper liste
- Karbon-sinkbatterier
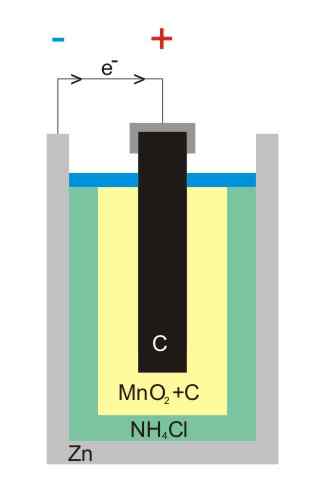 Sink-karbon-batteriillustrasjon
Sink-karbon-batteriillustrasjon Karbon-sinkbatterier (også kjent som leclanché eller Salinas pilasceller) er en av de mest primitive, og regnes for tiden som nesten brukt foran andre batterier; Spesielt foran de alkaliske batteriene, som selv om de er litt dyrere, har de en levetid og store spenninger.
Som navnet tilsier, består elektroder av en boks med sink og en grafittstang, tilsvarende anoden og katoden.
I den første elektroden stammer anoden elektronene ved oksidasjon av den metalliske sink. Disse elektronene reiser deretter en ekstern krets som mater enheten med strøm, og ender deretter i grafittkatoden, hvor syklusen er fullført når mangandioksid reduseres der den er nedsenket.
Reaksjoner
De kjemiske ligningene for reaksjonene som oppstår i elektrodene er:
Zn (S) → Zn2+(AC) + 2E- (Anode)
2 Mno2(S) + 2e- + 2 nh4CL (AC) → MN2ENTEN3(S) + 2 NH3(AC) + H2Eller (l) + 2 cl- (AC) (katode)
Disse batteriene ligner veldig på alkalisk: begge er sylindriske (for eksempel bildet). Imidlertid kan karbon-sink-batterier skilles ut hvis egenskapene merket i utlandet leses i detalj, eller hvis IEC-koden din er foran med bokstav R. Spenningen er 1,5 V.
- Alkaliske batterier
Alkaliske batterier ligner veldig på karbon-sink-typen, med forskjellen at mediet der elektrodene inneholder OH-anioner-. Dette mediet består av sterke elektrolytter av kaliumhydroksyd, KOH, som bidrar med OH- som deltar og "samarbeider" i migrasjonen av elektroner.
Den kommer i forskjellige størrelser og spenninger, selv om det vanligste er 1,5V. De er kanskje de mest kjente batteriene i markedet (for eksempel Duracell).
Reaksjonene som oppstår i elektrodene deres er:
Zn (S) + 2OH-(Aq) → ZnO (S) + H2Eller (l) + 2e- (Anode)
2mn2(S) + H2Eller (l) + 2e- → Mn2ENTEN3(S) + 2OH-(aq) (katode)
Når temperaturen øker, oppstår reaksjonene raskere og raskere blir batteriene utskrevet. Interessant nok ble populære rykter kjørt for å sette dem i fryseren for å øke levetiden; Men når avkjøling kan innholdet lide mulige størkninger som gir ytterligere mangler eller risikoer med dem.
Kvikksølv
 Sannsynlig kvikksølvbatteri, som kan forveksles med sølvoksydbatteriet. Kilde: Multicherry [CC0].
Sannsynlig kvikksølvbatteri, som kan forveksles med sølvoksydbatteriet. Kilde: Multicherry [CC0]. Kvikksølvbatterier er veldig karakteristiske på grunn av deres særegne skam over sølvknapper (overlegen bilde). Nesten alle vil kjenne dem igjen ved første øyekast. De er også alkalisk, men katoden deres inkorporerer, i tillegg til grafitt- og mangandioksid, kvikksølvoksid, HGO; som etter å ha redusert, blir metallisk kvikksølv:
Zn (S) + 2OH-(AC) → ZnO (S) + H2Eller (l) + 2e-
HGO (S) + H2O + 2E- → Hg (S) + 2OH-
Kan tjene deg: magnesiumoksyd: struktur, egenskaper, nomenklatur, brukMerk hvordan OH -anionene i disse cellereaksjonene konsumeres og regenereres-.
Å være små batterier, er det beregnet på små gjenstander, for eksempel klokker, kalkulatorer, lekekontroller, etc. Som har brukt noen av disse objektene vil ha lagt merke til at det ikke er nødvendig å endre batteriene for nesten en "evighet"; som ville være 10 år gammel, omtrent.
Sølvoksid
 Sølvoksydbatterier. Kilde: Lukas A, Cze [Public Domain].
Sølvoksydbatterier. Kilde: Lukas A, Cze [Public Domain]. Hoveddefekten av kvikksølvbatterier er at når de blir kastet, representerer de et alvorlig problem for miljøet, på grunn av de giftige egenskapene til nevnte metall. Kanskje dette mangler IEC og ANSI -koder mangler. For sølvoksydbatterier er IEC -koden foran med bokstaven S.
En av erstatningene for kvikksølvbatterier tilsvarer sølvoksyd, mye dyrere, men av mindre økologisk innvirkning (overlegen bilde). I begynnelsen inneholdt de kvikksølv for å beskytte sink mot alkalisk korrosjon.
Den er tilgjengelig med en spenning på 1,5V, og bruksområdene er veldig lik de for Mercury Pila. Ved første øyekast ser begge batteriene identiske ut; Selv om det kan være mye større sølvoksydbatterier.
Reaksjonene i elektrodene deres er:
Zn (S) + 2OH-(AC) → Zn (OH)2(S) + 2 E-
AG2Eller (s) + 2H+(AC) + 2E- → 2Ag (S) + H2Eller (l)
Vann lider deretter elektrolyse, nedbrytning av H -ioner+ Og åh-.
Legg merke til at i stedet for kvikksølv, dannes det i metall sølvkatoden.
- Nikkel-Cadmium Pilas (NICAD)
 NICD -batteri. Kilde: Lordider [CC0].
NICD -batteri. Kilde: Lordider [CC0]. Fra dette tidspunktet vurderes sekundære batterier eller batterier. I likhet med kvikksølv er nikkel-kadmiumbatterier skadelig for miljøet (for fauna og helse) av kadmiummetall.
De er preget av å generere høye elektriske strømmer og et stort antall ganger kan lades opp. Faktisk kan 2000 ganger lades opp, noe som er lik ekstraordinær holdbarhet.
Elektrodene består av nikkeloksidhydroksid, barn (OH), for katoden og metallisk kadmium for anoden. Chemical Foundation, i hovedsak, forblir det samme: kadmium (i stedet for sink) mister elektroner, og kadmium nio (OH) vinner dem.
De halvklare reaksjonene er:
CD (S) + 2OH-(AC) → CD (OH)2(S) + 2e-
2nio (OH) (S) + 2H2Eller (l) + 2e- → 2ni (OH)2(S) + OH-(AC)
Å anioner-, Igjen kommer de fra KOH -elektrolytten. NICAD -batterier, ender opp med å generere nikkel- og kadmiummetallhydroksider.
De brukes individuelt eller koblet i pakker (for eksempel gult, overlegen bilde). De kommer da i store eller små pakker. De små finner bruk i leker; Men de store, er bestemt til fly og elektriske kjøretøyer.
- Nikkel-hydro metallisk pilas (Ni-HM)
 Ni-HM-batterier. Kilde: Ramsh Ng of Flickr (https: // www.Flickr.com/bilder/rameshng/5645036051)
Ni-HM-batterier. Kilde: Ramsh Ng of Flickr (https: // www.Flickr.com/bilder/rameshng/5645036051) Et annet kjent batteri eller batteri, og som overstiger NICADs i energikapasiteter, er Ni-HM (nikkel og metallisk hydrid). Det kan komme i sylindrisk format (konvensjonelle batterier, overlegen bilde), eller koblet i et batteri.
Kjemisk presenterer nesten de samme egenskapene som NICAD -batterier, med hovedforskjellen basert på dens negative elektrode: katoden er ikke kadmium, men av en intermetallisk legering av sjeldne jordarter og overgangsmetaller.
Kan tjene deg: roterende tørketrommel: drift, hva er det for, deler, applikasjonerDenne legeringen er ansvarlig for å absorbere hydrogen dannet under belastningen, og generere et komplekst metallhydrid (derav bokstaven H i navnet).
Mens Ni-HM-batterier gir mer energi (omtrent 40% mer), er dyrere, bruker de raskere og kan ikke lastes på nytt på samme antall ganger som NICAD-batterier; det vil si at de har lavere levetid. Imidlertid mangler de minneeffekten (tap av batteriets ytelse ved ikke å bli fullstendig utskrevet).
Det er av denne grunn at de ikke skal brukes i maskiner som arbeider på lang sikt; Selv om dette problemet er pakket med LSD-NIHM-batteriene. På samme måte har Ni-HM-batterier eller batterier veldig stabile termiske egenskaper, og kan brukes i et bredt spekter av temperaturer uten å representere en risiko.
Reaksjoner
Reaksjonene som oppstår i elektrodene deres er:
Ni (å)2(S)+ OH-(AC) ⇌ NIO (OH) (S) + H2Eller (l) + e-
H2Eller (l) + m (s) + e- ⇌ Åh-(AC)+ MH (S)
- Ion-litio-batterier
 Litium-ion-batteri på en bærbar PC. Kilde: Kristoferb of Wikipedia.
Litium-ion-batteri på en bærbar PC. Kilde: Kristoferb of Wikipedia. I batteriene og litiumbatteriene er de basert på migrasjonen av Li -ionene+, som overføres fra anoden til katoden, produkt av elektrostatisk frastøtninger ved den økende positive ladningen.
Noen kan lade opp, for eksempel bærbare batterier (overlegen bilde) og andre, sylindriske og rektangulære (glatte2, Lisocl2 eller limousine2) Nei.
Ion-litio-batterier er preget av å være veldig lys og energi, noe som gjør at de kan brukes på mange elektroniske enheter, for eksempel smarttelefoner og medisinsk utstyr. De lider også knapt av minneeffekten, deres belastningstetthet overstiger de for NICAD- og Ni-HM-batterier og batterier, og forsinker mer i nedlasting.
Imidlertid er de veldig følsomme for høye temperaturer, til og med eksploderende; Og i tillegg er de vanligvis dyrere foran andre batterier. Likevel blir litiumbatterier i markedet sett med gode øyne, og mange forbrukere kvalifiserer dem som de beste.
- Syre blybatterier
 Typisk bilbatteri batteri. Kilde: TNTFLASH [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Typisk bilbatteri batteri. Kilde: TNTFLASH [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Og til slutt inneholder syre blybakterier, som navnet tilsier, ikke OH -ioner- men h+; Spesifikt en konsentrert løsning av svovelsyre. Voltaiske celler er inne i boksene sine (øvre bilde), der tre eller seks av dem kan kobles i serie, og gir et batteri på henholdsvis 6 eller 12 V.
Den er i stand til å generere store mengder elektrisk lading, og fordi de er veldig tunge, er de bestemt til applikasjoner eller enheter som ikke kan transporteres manuelt; For eksempel biler, solcellepaneler og ubåter. Dette syrebatteriet er det eldste og er fremdeles i kraft i bilindustrien.
Elektrodene dine er laget av bly: PBO2 For katode, og svampaktig metallisk bly for anode. Reaksjonene som forekommer i dem er:
PB (S) +HSO-4(AQ) → PBSO4(S) +H+(aq) + 2e-
PBO2(S) +HSO-4(aq) + 3H+(aq) + 2e- → PBSO4(S) + 2H2Eller (l)
Referanser
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Odunlade Emmanuel. (24. juli 2018). Forskjellige typer batterier og applikasjoner. Circuit Digest. Gjenopprettet fra: CircuitDigest.com
- Prba. (s.F.). Typer batterier. Gjenopprettet fra: PRBA.org
- Isidor Buchman. (2019). Hva er det beste batteriet? Batteriuniversitet. Hentet fra: BatteryUniversity.com
- McGraw-Hill-selskapene. (2007). Kapittel 12: Batterier. [PDF]. Gjenopprettet fra: Oakton.Edu
- Shapley Patricia. (2012). Vanlige batterityper. University of Illinois. Gjenopprettet fra: Butan.Chem.Uiuc.Edu
- Økologisk holdning. (22. januar 2017). Typer batterier: Komplett guide med batterier og batterier som finnes. Hentet fra: Ekkologisk.com
- « Tomás Mejía biografi, militær karriere, skyting
- Syreanhydrider Hvordan dannes, applikasjoner og eksempler »

