Toluenstruktur, egenskaper, bruk
- 2995
- 102
- Jonathan Carlsen
Han Toluen Det er en aromatisk hydrokarbon hvis kondenserte formel er c6H5Ch3 eller phch3 og det består av en metylgruppe (CH3) sammen med en benzen ring eller fenylgruppe (pH). Det finnes naturlig i råolje, i kull, i vulkanutslipp og i noen trær, for eksempel Tolú de América i Sør.
Denne karakteristiske lukten av lukten brukes hovedsakelig som et industrielt råstoff, og som en maling fortynningsmiddel. Det brukes også i eliminering av parasitter som er til stede hos katter og hunder, for eksempel ascarider og anylostomer.
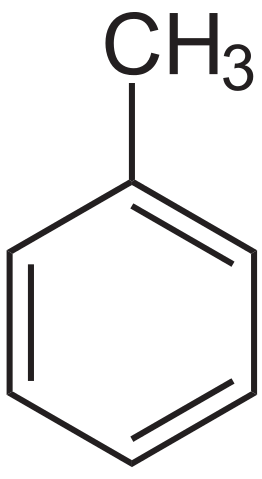
 Toluenstrukturformel. Kilde: Neurotoger via Wikipedia.
Toluenstrukturformel. Kilde: Neurotoger via Wikipedia. Toluen ble isolert for første gang av Pierre-Joseph Pelletier og Philippe Walter, i 1837, av furuolje. Deretter isolerte Henri Etienne Sainte-Claire Deville, i 1841, den fra Tolú-balsam og påpekte at produktet var lik den tidligere isolerte. I 1843 døpte Berzelius ham som Toluin.
Det meste av toluen oppnås som et lateralt eller sekundært produkt i gassproduksjonsprosesser og kullkonvertering til koks. Det er også produsert av reaksjoner gjort i laboratoriet, for eksempel benzenreaksjonen med metylklorid.
[TOC]
Struktur
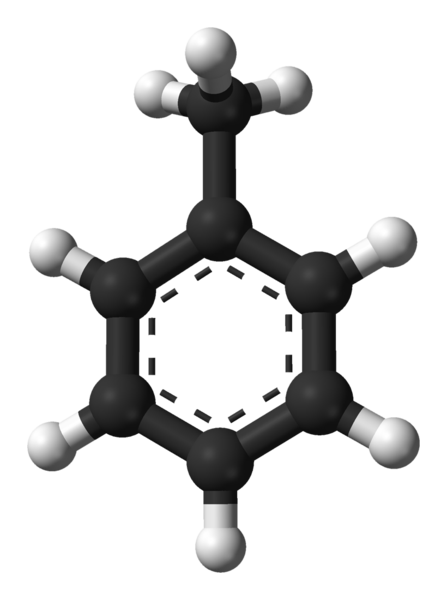 Molekylær struktur av toluen. Kilde: Ben Mills via Wikipedia.
Molekylær struktur av toluen. Kilde: Ben Mills via Wikipedia. I det overlegne bildet har vi molekylstrukturen til toluenet representert av en modell av kuler og barer. Merk at det ser nøyaktig ut som den strukturelle formelen som er angitt, med forskjellen at det ikke er et flatt molekyl fullstendig.
I midten av benzenringen, som i dette tilfellet kan sees på som en fenylgruppe, blir dens aromatiske karakter fremhevet gjennom de stiplede linjene. Alle karbonatomer har SP -hybridisering2, Bortsett fra CHO -gruppen3, hvis hybridisering er SP3.
Det er av denne grunn at molekylet ikke er helt flatt: Cho hydrogener3 De er lokalisert i forskjellige vinkler på Benzenic Ring -planet.
Kan tjene deg: ionisering konstantToluen er et apolar, hydrofob og aromatisk molekyl. Dens intermolekylære interaksjoner er basert på de spredende kreftene i London, og i Dipolo-dipolo-interaksjoner, siden midten av ringen er "lastet" av elektronisk tetthet levert av CH3; Mens hydrogenatomer har lav elektronisk tetthet.
Derfor har toluen flere typer intermolekylære interaksjoner som holder molekylene i deres flytende sammenhengende. Dette gjenspeiles i kokepunktet, 111 ° C, som er høyt med tanke på at det er et apolar løsningsmiddel.
Egenskaper
Fysisk utseende
Fargeløs og gjennomsiktig væske
Molmasse
92,141 g/mol
Lukt
Søt, dekar og ligner på benzen
Tetthet
0,87 g/ml ved 20 ºC
Smeltepunkt
-95 ºC
Kokepunkt
111 ºC
Løselighet
Toluen har foraktelig løselighet i vann: 0,52 g/l ved 20 ° C. Dette på grunn av forskjellen i polariteter mellom toluen og vann.
På den annen side er toluen løselig, eller i dette tilfellet blandbar, med etanol, benzen, etyleter, aceton, kloroform, iseddiksyre og karbondisulfid; det vil si at det er bedre solubilisert i mindre polare løsningsmidler.
Brytningsindeks (nD)
1.497
Goo
0,590 cp (20 ºC)
tenningspunkt
6 ºC. Toluen må manipuleres i gassutvinning av leirer og så langt unna som mulig fra en hvilken som helst flamme.
Damptetthet
3.14 i luftforhold = 1. Det vil si at damper er tre ganger tettere enn luften.
Damptrykk
2.8 kPa ved 20 ° C (ca. 0.27 atm).
Selv -tisningstemperatur
480 ° C
Nedbrytning
Kan reagere kraftig med oksidasjonsmaterialer. Når han er oppvarmet til nedbrytning, avgir han en dekar og irriterende røyk.
Overflatespenning
29,46 mn ved 10 ºC
Dipolar øyeblikk
0,36 d
Reaktivitet
Toluen er utsatt for klorering for å produsere orto-klorotoluen og para-cllorotoluen. Det er også enkelt å nitrifisere for å produsere nitrotoluen, som er råstoffet til fargestoffene.
Kan tjene deg: atomvektEn del av toluen er kombinert med tre deler salpetersyre for å forårsake trinitrotoluen (TNT): en av de mest kjente eksplosivene.
På samme måte opplever toluen sulfonering for å generere O-toluens-sulfoniske og P-toluens-sulfonsyrer, som er råstoffet for fremstilling av fargestoffer og sakkarin.
Toluenmetylgruppen opplever tap av hydrogen på grunn av virkningen av en sterk base. Metylgruppen er også utsatt for oksidasjon, så den reagerer med kaliumpermanganat for å forårsake benzoisk og benzaldehydsyre opprinnelig.
applikasjoner
Industriister
 TNT, det mest symbolske eksplosivet av alle, skjer av toluenet som hoved råstoff. Kilde: Pixabay.
TNT, det mest symbolske eksplosivet av alle, skjer av toluenet som hoved råstoff. Kilde: Pixabay. Toluen brukes til utdyping av malerier, fortynninger av maling, neglelakk, lim eller pasta med pasta, lakk, blekk, nylon, plast, polyuretanskum, de fleste oljer, vinylorganer, medisiner, fargestoffer, parfymer, eksplosiver (TNT).
På samme måte brukes toluen i form av toluenosulfonados i fremstilling av vaskemiddel. Toluen er også av stor betydning i fremstilling av plastsement, kosmetisk fargestaker, frostvæske, blekk, asfalt, permanente markører, kontaktsement, etc.
Løsningsmiddel og fortynningsmiddel
Toluen brukes i fortynning av maleriene, noe som letter bruken. Den brukes til å løse opp kantene på polystyrenesettene, og tillater dermed forening av delene som utgjør modeller av skala -fly. I tillegg brukes det i utvinning av naturlige produkter fra planter.
Toluen er et blekkløsningsmiddel som brukes i det graverte hullet. Sement blandet med gummi og toluen brukes til å dekke et stort antall produkter. På samme måte brukes toluen som et løsningsmiddel i utskriftsblekk, lakk, lærbrennere, lim og desinfeksjonsmidler.
Kan tjene deg: molar absorberendeOg enda mer interessant, brukes toluen som et løsningsmiddel av karbon nanomaterialer (for eksempel nanorør) og fullerenos.
Andre
En blanding av benzen, toluen og xylen (BTX) tilsettes bensin for å øke oktanen. Toluen er et tilsetningsstoff av flymass og høy oktanreserve. Det brukes også i utdypingen av NAFTA.
Toluen hjelper til med å eliminere noen arter av ascárides og anquilostomos, samt tenias som er parasitter av katter og hunder.
Å skaffe
Det meste av toluenet oppnås fra destillerte produkter fra råolje, generert under hydrokarbonpyrolyse (dampsprekker). Den katalytiske reformen av oljedamper representerer 87 % av den produserte toluenen.
Ytterligere 9 % av toluen fra pyrolyse bensin produsert under fremstilling av etylen og propylen.
Hulla Tar of Coke Ovens bidrar med 1 % av toluenen som er produsert, mens de resterende 2 % oppnås som et biprodukt av produksjonen av strekningen.
Skadelige effekter
Toluen er et løsningsmiddel som er inhalert for å bli høyt, siden det har en narkotisk handling som påvirker funksjonen til sentralnervesystemet. Toluen kommer inn i kroppen for inntak, innånding og absorpsjon gjennom huden.
På et eksponeringsnivå på 200 ppm, kan eksitasjon, eufori, hallusinasjoner, forvrengte oppfatninger, hodepine og svimmelhet oppstå. Mens høyere nivåer av tolueneksponering kan gi depresjon, døsighet og dumhet.
Når innånding overstiger en konsentrasjon på 10.000 ppm, er i stand til å produsere individets død på grunn av respirasjonssvikt.
Referanser
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. (10th Utgave.). Wiley Plus.
- Carey f. (2008). Organisk kjemi. (Sjette utgave). Mc Graw Hill.
- Morrison og Boyd. (1987). Organisk kjemi. (Femte utgave). Addison-Wesley Iberoamericana.
- Nasjonalt senter for bioteknologiinformasjon. (2020). Toluen. PubChem -database., CID = 1140. Gjenopprettet fra: Pubchem.NCBI.NLM.NIH.Gov
- Wikipedia. (2020). Toluen. Hentet fra: i.Wikipedia.org
- Engineering Toolbox, (2018). Toluen - Termofysiske egenskaper. [Online] Gjenopprettet fra: EngineeringToolbox.com
- Vedantu. (s.F.). Toluen. Gjenopprettet fra: Vedantu.com
- « Destruktiv interferensformel og ligninger, eksempler, trening
- Polyvinylpirrolidonstruktur, egenskaper, bruksområder, bivirkninger »

