Atomisk volum
- 1530
- 80
- Thomas Karlsen
Hva er atomvolum?
Han Atomisk volum Det er en relativ verdi som indikerer forholdet mellom molmassen til et element og dens tetthet. Deretter avhenger dette volumet av elementets tetthet, og tettheten avhenger av fasen og hvordan atomer er bestilt i dette.
Slik at atomvolumet for et z -element ikke er det samme i en annen annen fase enn at det viser ved romtemperatur (væske, fast stoff eller gass), eller når det er en del av visse forbindelser. Dermed er atomvolumet til Z i ZB -forbindelsen forskjellig fra Z i ZB -forbindelsen.
Fordi? For å forstå det er det nødvendig å sammenligne atomene med for eksempel noen klinkekuler. Marmorene har sin materialgrense veldig godt definert, som blir observert takket være deres strålende overflate. På den annen side er grensen til atomer diffus, selv om de kan betraktes som ekstern sfærisk.

Det som bestemmer et punkt utover atomgrensen er dermed sannsynligheten for å finne et elektron, og dette punktet kan være lenger eller nærmere kjernen, avhengig av hvor mange nærliggende atomer som interagerer rundt atomet i betraktning.
Atomisk volum og radio
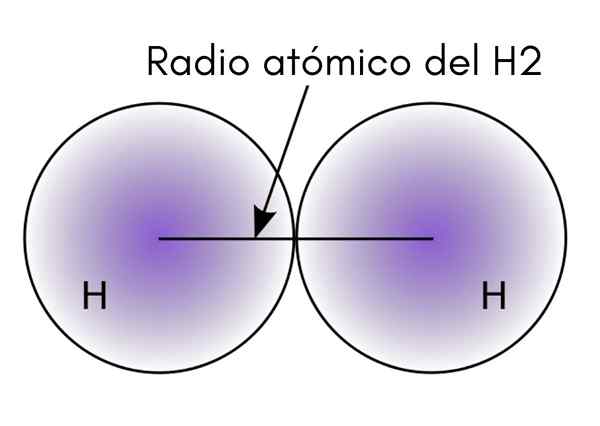
Når du samhandler to H -atomer i H -molekylet2, Posisjonene til deres kjerner er definert så vel som avstandene mellom dem (internukleære avstander). Hvis begge atomene er sfæriske, er radius avstanden mellom kjernen og den diffuse grensen:

I det overlegne bildet kan det sees hvordan sannsynligheten for å finne et elektron avtar når det beveger seg bort fra kjernen. Deling med to internukleær avstand, oppnås atomradius. Deretter, forutsatt en sfærisk geometri for atomer, brukes formelen til å beregne volumet til en sfære:
V = (4/3) (pi) r3
Kan tjene deg: brennbarhetI dette uttrykket er r atomradius som er bestemt for H -molekylet2. V -verdien beregnet med denne lille presise metoden kan endres hvis for eksempel h vurderes2 i flytende eller metallisk tilstand. Imidlertid er denne metoden veldig unøyaktig fordi atomer er veldig langt fra den ideelle sfæren i deres interaksjoner.
For å bestemme atomvolumer i faste stoffer, tas mange variabler angående ordningen med hensyn til, og som oppnås ved røntgendiffraksjonsstudier.
Ytterligere formel
Den molære massen uttrykker mengden materie som har en mol atomer av et kjemisk element.
Enhetene er g/mol. På den annen side er tettheten volumet som opptar et gram av elementet: g/ml. Fordi atomvolumenhetene er ml/mol, må du leke med variablene for å nå de ønskede enhetene:
- (g/mol) (ml/g) = ml/mol
Eller hva er det samme:
- (Molmasse) (1/d) = v
- (Molmasse/d) = v
Dermed kan volumet av en mol atomer i et element lett beregne; Mens med formelen til det sfæriske volumet beregnes volumet til et individuelt atom.
For å nå denne verdien fra den første, er en konvertering nødvendig gjennom Avogadro -nummeret (6.02 · 10-23).
Hvordan varierer atomvolum i det periodiske tabellen?
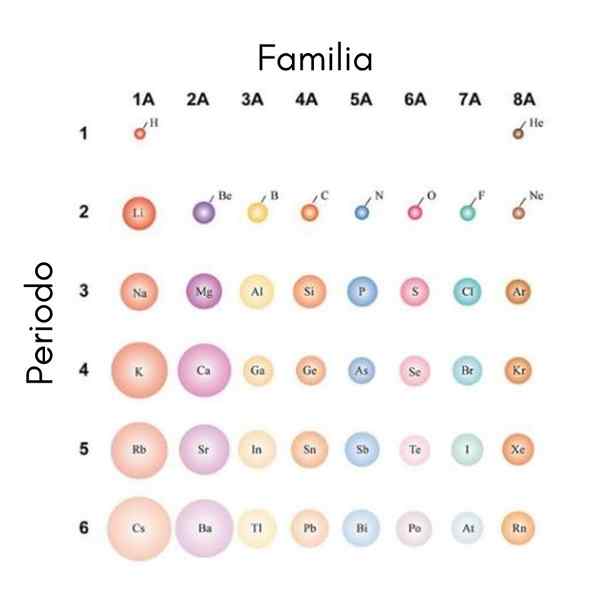
Hvis atomene anses som sfæriske, vil variasjonen deres være den samme som observeres i atomradioer. I det overordnede bildet, som viser de representative elementene, illustreres det at fra høyre til venstre atomene dverger; På den annen side, fra topp til bunn, blir disse mer klumpete.
Dette er fordi kjernen i samme periode inneholder protoner når den beveger seg til høyre. Disse protonene utøver en attraksjonskraft på ytre elektroner, som føler en effektiv kjernefysisk belastning zEf, mindre enn ekte atombelastning z.
Det kan tjene deg: disposio: struktur, egenskaper, innhenting, brukElektronene til de indre lag frastøter de ytre laget, og reduserer effekten av kjernen på dem; Dette er kjent som skjermeffekten. I samme periode klarer ikke skjermeffekten å motvirke økningen i antall protoner, slik at elektronene i det indre laget ikke forhindrer sammentrekning av atomer.
Når du synker i en gruppe, er det imidlertid aktivert nye energinivåer, som lar elektroner gå i bane rundt kjernen. På samme måte økes antall elektroner i det indre laget, hvis skjermingseffekter begynner å bli redusert hvis kjernen legger til protoner igjen.
Av disse grunner blir det satt pris på at gruppe 1A har de mest klumpete atomer, i motsetning til de små atomene i gruppe 8a (eller 18), den av edle gasser.
Atomiske volum av overgangsmetaller
Atomer av overgangsmetaller inneholder elektroner i indre orbitaler d. Denne økningen i skjermeffekten og, så vel som den virkelige kjernefysiske Z, er nesten like annullert, så atomene deres beholder lignende størrelse i samme periode.
Med andre ord: I en periode viser overgangsmetaller lignende atomvolumer. Imidlertid er disse små forskjellene enormt signifikante når de definerer metallkrystaller (som om de var metalliske klinkekuler).
Eksempler på atomvolum
To matematiske formler er tilgjengelige for å beregne atomvolumet til ett element, hver med tilhørende eksempler.
Eksempel 1
Gitt det atomiske radiogrogen -37 pm (1 picometer = 10-12m) -og cesium -265 pm-, beregne atomvolumene dine.
Kan tjene deg: benzaldehydVed hjelp av den sfæriske volumformelen har du da:
VH= (4/3) (3.14) (37 pm)3= 212.07 pm3
VCS= (4/3) (3.14) (265 pm)3= 77912297.673
Imidlertid er disse volumene uttrykt i pikometre ublu, så de forvandles til angstroms -enheter, og multipliserer dem med konverteringsfaktoren (1Å/100 pm)3:
(212.073) (1Å/100 pm)3= 2.1207 × 10-4 TIL3
(77912297.673) (1Å/100 pm)3= 77.912 Å3
Dermed er forskjellene i størrelse mellom det lille H -atomet og det voluminøse atomet til CS numerisk bevist. Det er nødvendig å ta hensyn til at disse beregningene ikke er mer enn tilnærminger under uttalelsen om at et atom er helt sfærisk, noe som skiller virkeligheten.
Eksempel 2

Tettheten av rent gull er 19,32 g/ml og dens molmasse er 196,97 g/mol. Påføring av m/d -formelen for å beregne volumet til en mol gullatomer, er følgende:
VAu= (196,97 g/mol)/(19,32 g/ml) = 10,19 ml/mol
Det vil si at 1 mol gullatomer opptar 10,19 ml, men hvilket volum okkuperer et gullatom spesifikt? Og hvordan du uttrykker det i PM -enheter3? For dette, bare bruk følgende konverteringsfaktorer:
(10,19 ml/mol) · (mol/6,02 · 10-23 atomer) · (1 m/100 cm)3· (13.00/10-12m)3= 16.92 · 106 p.m3
På den annen side er den atomradius av gull 166 pm. Hvis begge volumene blir sammenlignet - den som er oppnådd ved den forrige metoden og som beregnes med formelen til det sfæriske volumet - vil det bli funnet at de ikke har samme verdi:
VAu= (4/3) (3.14) (166 pm)3= 19,15 · 106 p.m3
Hvilken av de to er nærmere den aksepterte verdien? Den som er nærmest de eksperimentelle resultatene oppnådd ved røntgendiffraksjon av den krystallinske strukturen av gull.

