Bariumoksyd (BAO) struktur, egenskaper, bruksområder, risikoer

- 2420
- 609
- Jonathan Moe
Han bariumoksid Det er et uorganisk fast stoff dannet av et bariumatom (BA) og et oksygen (O) atom. Den kjemiske formelen er bao. Det er et hvitt krystallinsk fast stoff og er hygroskopisk, det vil si at det absorberer fuktigheten i luften, men ved å gjøre det reagerer det med dette.
Den raske reaksjonen av bariumoksyd med vann gjør det brukt i laboratorier for kjemisk analyse, det vil si å eliminere vann fra organiske løsningsmidler, som er flytende forbindelser som tjener til å oppløse andre stoffer.
 Solid bao bariumoksid. Lem [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons.
Solid bao bariumoksid. Lem [CC By-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]. Kilde: Wikimedia Commons. Bao oppfører seg som en sterk base, reagerer derfor med mange typer syrer. Reagerer for eksempel lett med karbondioksid2 av luften for å danne bariumkarbonatbacchus3.
Den serverer i fremstilling av polymerer for strømkabler og som en harpikser ingrediens for å forsegle tennhull som er blitt kurert.
Bariumoksid (BAO) brukes også i keramisk industri, både for å dekke den med glass og for å produsere den. Det brukes også i sementblandinger for å øke kompresjonsmotstanden til sluttproduktet.
[TOC]
Struktur
Bao baaroksid dannes av en kation ba2+ og en oksygenanion eller2-.
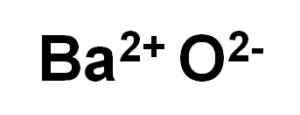 Bao bariumoksidioner. Forfatter: Marilú Stea.
Bao bariumoksidioner. Forfatter: Marilú Stea. I sine krystaller danner Bao kubiske ioniske nettverk (i form av en kube) av natriumkloridtypen.
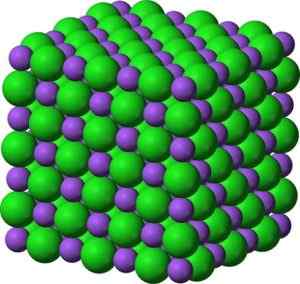 Bao bariumoksyd -formet krystallinsk struktur som ligner på natriumklorid. Grønn: Barium. Blå: Oksygen. Benjah-BMM27 (Talk · bidrag) [Public Domain]. Kilde: Wikimedia Commons.
Bao bariumoksyd -formet krystallinsk struktur som ligner på natriumklorid. Grønn: Barium. Blå: Oksygen. Benjah-BMM27 (Talk · bidrag) [Public Domain]. Kilde: Wikimedia Commons. Den elektroniske konfigurasjonen av bariumionen er: [xe] 6s0 Vel, de to elektronene i 6S -laget har tapt. Denne konfigurasjonen er veldig stabil.
Nomenklatur
-Bariumoksid
-Bariummonoksid
Det kan tjene deg: Test: Kjennetegn, typer, eksempler på brukFysiske egenskaper
Fysisk tilstand
Gulaktig hvit krystallinsk faststoff.
Molekylær vekt
153,33 g/mol
Smeltepunkt
1923 ºC
Kokepunkt
Omtrent 2000 ºC.
Tetthet
5,72 g/cm3
Løselighet
Lite vannoppløselig: 3,8 g/100 ml ved 20 ºC.
Kjemiske egenskaper
Bario Bao -oksid reagerer raskt2, som er det mest oppløselige hydroksydet mellom alkaleteriske metallhydroksider.
Bao + h2O → BA (OH)2
Bao er en sterk base. Reagerer eksotermisk (det vil si med varmeavløsning) med alle typer syrer.
Med co2 Bao reagerer på å danne bariumkarbonatbacchus3.
Bao + co2 → Bacchus3
Bao er hygroskopisk, for hvis det er lov til miljøet, blir den gradvis sammenføyd til fuktigheten av luften, og danner BA (OH)2 som er kombinert med karbondioksid2 av luften for å gi bariumkarbonatbacchus3.
Når Bao -bariummonoksid blir oppvarmet i nærvær av luft, er det kombinert med oksygendannende bariumperoksyd Bao2. Reaksjonen er reversibel.
2 bao + o2 ⇔ 2 bao2
I nærvær av vann kan det reagere med aluminium til OR med FIFC Zn som danner oksydene eller hydroksider av disse metallene og genererer hydrogengass H2.
Du kan starte polymerisasjon av organiske forbindelser som kan polymeriseres, for eksempel epoksider.
Risiko
Det kan være giftig ved inntak. Du skal ikke kontakte huden. Det er irriterende øyne, hud- og luftveisanalen. Det kan være skadelig for nervesystemet. Det er i stand til å forårsake lave nivåer av kalium, noe som resulterer i hjerte- og muskelforstyrrelser.
Å skaffe
Bao bariumoksid kan oppnås ved å varme opp bario baco karbonat3 Med kull. Bao er dannet og karbonmonoksidgass frigjøres.
Bacchus3 + C → BAO + 2 CO ↑
applikasjoner
Som tørkemiddel av organiske løsningsmidler
På grunn av det lett å reagere med vann, har Bao blitt brukt siden midten av forrige århundre som tørkemiddel for bensin og grunnleggende organiske løsningsmidler.
Det kan tjene deg: cyanhydronsyre: molekylstruktur, egenskaper, bruksområderBao er veldig aktiv tørking rundt den, den tar fuktighet veldig raskt, med evolusjon av ganske varme, og danner bariumhydroksyd BA (OH)2 som er stabil opp til omtrent 1000 ºC. Derfor kan BAO brukes ved høye temperaturer.
Den har også en høy vannabsorpsjonskapasitet. For hvert BAO -molekyl kan man absorbere et vann og BA (OH)2 resulterende kan også absorbere en viss mengde vann.
Det er egnet for analytiske kjemilaboratorier. Det er ikke klissete.
Det kan brukes i tørkatorer, som er store glassbeholdere med lokk der den tørre indre atmosfæren opprettholdes. Bao holder miniatmosfæren til uttørkatoren tørr.
 Distinters i et laboratorium. Det tørkende stoffet som Bao er plassert i bunnen av basen. Den opprinnelige opplasteren var Rifleman 82 på engelsk Wikipedia. [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons.
Distinters i et laboratorium. Det tørkende stoffet som Bao er plassert i bunnen av basen. Den opprinnelige opplasteren var Rifleman 82 på engelsk Wikipedia. [CC By-SA 3.0 (http: // creativecommons.Org/lisenser/by-SA/3.0/]]. Kilde: Wikimedia Commons. Disse uttørkatorene tjener til å plassere stoffer eller reagenser og forhindrer dem dermed i å absorbere vann fra miljøet.
Det tjener også til å tørke grunnleggende gasser som ammoniakk NH3.
I nedlastingslamper
BAO er plassert i elektrodene til utløpslampene som et elektron -emitterende materiale.
Utladningslamper dannes av et glassrør, kvarts eller annet passende materiale, inneholder en inert gass og i de fleste tilfeller en metalldamp. Metallisk damp kan være natrium eller kvikksølv.
 Kvikksølvlampe. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Kvikksølvlampe. Dmitry G [CC BY-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Inne i røret oppstår elektrisk støt fordi det har en positiv og en negativ elektrode.
Bao er plassert i lampeelektroder. Elektronene som sendes ut kolliderer med metalldampatomer og overfører energi.
Det kan tjene deg: Cupric Oxide (CUO)Når du fører en elektrisk strøm gjennom denne gassen eller dampen, er det synlig lys eller ultrafiolett stråling (UV).
I keramisk produksjon
Bao brukes i glaserte keramiske beleggsammensetninger.
 Belagt bygningsfasade med glasert keramikk. Penny Mayes/Glazed Façade. Kilde: Wikimedia Commons.
Belagt bygningsfasade med glasert keramikk. Penny Mayes/Glazed Façade. Kilde: Wikimedia Commons. Imidlertid har det også blitt testet som et tilsetningsstoff i forberedelsen av HOB.
Bao forbedrer effektivt mekaniske egenskaper og kjemisk motstand av denne typen keramiske. Det har en sterk innflytelse på termiske egenskaper og sammensetningen av den krystallinske fasen av materialene oppnådd.
Ved fremstilling av sementblandinger
BAO er testet som en komponent i fosfoaluminat sement.
Denne typen sement er nyttig i marine miljøer, siden den ikke har samme tendens til å hydrere som andre typer sement, så den lider ikke av pore eller utvidelse.
Imidlertid må fosfoalumineringssement styrkes i sin mekaniske ytelse for å tåle marine strømmer og slag med flytende isstykker i havet.
Tilsetningen av BAO til fosfoalumineringssementet modifiserer mineralstrukturen til nevnte materiale, forbedrer porens struktur og øker den komprimerende kraften i sementpasta betraktelig.
Med andre ord, BAO forbedrer kompresjonsresistens av denne typen sement.
 Bland for betong. Bao bariumoksid er nyttig for å forbedre visse sementegenskaper. Thamizhpparithi Maari [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Bland for betong. Bao bariumoksid er nyttig for å forbedre visse sementegenskaper. Thamizhpparithi Maari [CC By-SA 3.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. I flere applikasjoner
Det brukes som en ingrediens for å gi opacitet i tannharpikser for fylling av hull i tennene, utført av tannleger.
Det brukes også som et nukleasjonsmiddel for fremstilling av polyvinylidenfluoridpolymerer som brukes til å isolere strømkabler.
Referanser
- Partyka, J. et al. (2016). Effekt av tilsetning av BAO på sintring av glass-keramiske materialer fra SIO2-Til2ENTEN3-Na2GREIT2O-CAO/MGO-system. J Therm Anal Calim (2016) 125: 1095. Lenke gjenopprettet.Springer.com.
- Zhang, p. et al. (2019). Effekt av BAO på mineralstruktur og hydreringsatferd av fosfoaluminat sement. J Therm Anal Calim (2019) 136: 2319. Lenke gjenopprettet.Springer.com.
- ELLER.S. National Library of Medicine. (2019). Oksidbarium. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Smith, n.TIL. (2003). Belysning. Prinsipp. I Electrical Engineer's Reference Book (Sixteenth Edition). Gjenopprettet fra Scientedirect.com.
- Ebnejjad, s. (2003). Fluoropolymerskum. PVDF -skumming. I smelte prosessibel fluoroplast. Gjenopprettet fra Scientedirect.com.
- Booth, h.S. og McIntyre, L.H. (1930). Bariumoksid som en tørkemiddel. Ind. Eng. Chem. Anal. Ed. 1930, 2, 1, 12-15. Gjenopprettet fra puber.ACS.org.
- « Natriumcyanid (NaCN) struktur, egenskaper, risikoer, bruk
- De 15 beste matvarene for å øke rumpa (naturlig) »

