Fosforoksyd (V) Struktur, egenskaper, innhenting, bruk, risiko

- 2667
- 122
- Marius Aasen
Han Fosforoksyd (V) Det er et uorganisk fast stoff dannet av fosfor (P) og oksygen (O). Dens empiriske formel er P2ENTEN5, Mens den riktige molekylære formelen er P4ENTEN10. Det er et veldig hygroskopisk hvitt fast stoff, det vil si at det kan absorbere luft fra luften veldig enkelt, og umiddelbart reagere med dette. Reaksjonen kan være farlig fordi den forårsaker en rask økning i temperaturen.
Den høye tendensen til å absorbere vann har ført til at det brukes som et tørkemiddel i kjemiske laboratorier, samt dehydrering av noen forbindelser, det vil si å eliminere vann fra molekylene.
 Fosforoksyd (V) pulver, P4ENTEN10. LHCHEM [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons.
Fosforoksyd (V) pulver, P4ENTEN10. LHCHEM [CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/3.0)]. Kilde: Wikimedia Commons. Fosforoksyd (V) brukes også til å akselerere bindingsreaksjonene til molekyler av forskjellige hydrokarboner, og være en reaksjon som kalles kondensasjon. I tillegg tillater det å konvertere visse organiske syrer til estere.
Det har blitt brukt for eksempel for å avgrense bensin, for å fremstille fosforsyre H3Po4, For å skaffe forbindelser som tjener til å utsette brann, for å produsere glass for vakuumapplikasjoner, blant mange andre bruksområder.
Fosforoksyd (V) bør oppbevares i godt lukkede beholdere for å forhindre kontakt med fuktigheten fra luften. Det er etsende og kan skade øyne, hud og slim.
[TOC]
Struktur
Fosforoksyd (V) dannes av fosfor (P) og oksygen (O), hvor fosfor har valens på +5 og oksygen -2. Fosforoksydmolekylet (V) har fire fosfor og ti oksygenatomer, og det er derfor dens riktige molekylformel er P er P4ENTEN10.
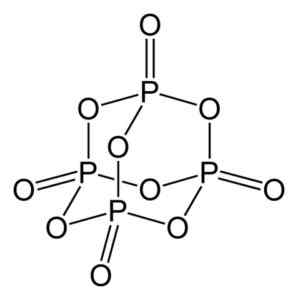 Struktur av fosforoksydmolekylet (V), P4ENTEN10. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons.
Struktur av fosforoksydmolekylet (V), P4ENTEN10. Forfatter: Benjah-BMM27. Kilde: Wikimedia Commons. Eksisterer i tre krystallinske former, for eksempel amorft støv og i glassaktig form (som glass). I den sekskantede krystallinske formen finnes hvert av fosforatomene i toppunktene til en tetrahedron.
Nomenklatur
- Fosforoksyd (V)
- Fosfor pentoksid
- Difosfack pentoksid
Kan tjene deg: løsningsmiddel: konsept, typer og eksempler- Fosforpentoksid
- Fosforanhydrid
- Tetrafosfor forfall
Egenskaper
Fysisk tilstand
Krystallinsk hvitt fast stoff. Den vanligste formen er den av sekskantede krystaller.
Molekylær vekt
283,89 g/mol
Smeltepunkt
562 ºC
Sublimeringstemperatur
360 ºC til 1 trykkatmosfære. Det betyr at ved denne temperaturen går fra gass faststoff uten å gå gjennom flytende tilstand.
Tetthet
2.30 g/cm3
Løselighet
Veldig løselig i vann. Svovelsyreoppløselig. Uoppløselig i aceton og ammoniakk.
Kjemiske egenskaper
Fosforoksyd (V) absorberer og reagerer med luft fra luften med ekstrem raskt dannende fosforsyre H3Po4. Denne reaksjonen er eksotermisk, noe som betyr at det produseres varme under den samme.
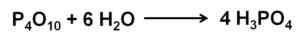 Fosfor (V) oksidreaksjon med vann for å danne fosforsyre H3Po4. Forfatter: Marilú Stea.
Fosfor (V) oksidreaksjon med vann for å danne fosforsyre H3Po4. Forfatter: Marilú Stea. Reaksjonen av P4ENTEN10 Med vann fører til dannelse av en blanding av fosforsyrer hvis sammensetning avhenger av mengden vann og forhold.
Reaksjonen med alkoholer fører til dannelse av fosforsyre eller polymersyreestere avhengig av eksperimentelle forhold.
P4ENTEN10 + 6 ROH → 2 (RO)2Po.Oh + 2 ro.PO (OH)2
Med grunnleggende oksider danner faste fosfater.
Det er etsende. Det kan reagere farlig med maursyre og uorganiske baser som natriumhydroksyd (NaOH), kalsiumoksyd (CaO) eller natriumkarbonat Na2Co3.
Hvis en HClo percloric acid -løsning helles4 og CHCL -kloroform3 I fosforoksyd (v) p4ENTEN10 En voldelig eksplosjon oppstår.
Andre egenskaper
Det er ikke brannfarlig. Favoriserer ikke forbrenning. Imidlertid er vannreaksjonen så voldelig og eksotermisk at det kan være brannrisiko.
Å skaffe
Det kan utarbeides ved direkte fosforoksidasjon i en tørr luftstrøm. Fosfor når oksygenoverskytende kontakt blir oksidert og danner fosforoksyd (V).
P4 + 5 o2 → s4ENTEN10
Tilstedeværelse i naturen
Fosforoksyd (V) finnes i mineraler som ilmenitt, rutilo og zircón.
Kan tjene deg: Hva er uorganiske kjemiske funksjoner?Ilmenitt. Rutilo er et titanoksydmineral og kan inneholde rundt 0,02% etter vekt på P2ENTEN5.
Zircón sand (et zirkoniumelementmineral) har fosfor (V) oksid ved 0,05-0,39 vekt%.
applikasjoner
Som en dehydrerings- og sikringsagent
På grunn av sin store aviditet for vann, er det et av de mest kjente og veldig effektive dehydreringsmidlene ved temperaturer mindre enn 100 ° C.
Kan trekke ut vann fra stoffer som regnes som dehydratiserende midler. For eksempel kan du fjerne vann fra svovelsyre H2SW4 gjør det slik3 og salpetersyre hno3 gjør det til n2ENTEN5.
 Svovelsyre dehydrering på grunn av fosforoksyd (V). Forfatter: Marilú Stea.
Svovelsyre dehydrering på grunn av fosforoksyd (V). Forfatter: Marilú Stea. I utgangspunktet kan den tørke alle de væskene og gassene som den ikke reagerer, så den tillater å fjerne spor av fuktighet fra vakuumsystemer.
I organiske kjemiske reaksjoner
Fosforoksyd (V) tjener til å lukke organiske sammensatte ringer og andre kondensasjonsreaksjoner.
Det gjør det mulig å sterifisere organiske syrer med muligheten til.
Det tjener også til å eliminere et H -molekyl2Eller av amidas r (c = o) nh2 Og det gjør dem til nitriler R-CN. I tillegg katalyserer eller akselererer oksygenering, dehydrogenering og polymerisasjon av bitumenreaksjoner.
 P4ENTEN10 Det er mye brukt i organiske kjemilaboratorier. Forfatter: JDN2001CN0. Kilde: Pixabay.
P4ENTEN10 Det er mye brukt i organiske kjemilaboratorier. Forfatter: JDN2001CN0. Kilde: Pixabay. I raffinering av drivstoff
Siden 1930 -tallet av det tjuende århundre indikerte visse studier at fosfor (V) oksid utøvde en gass raffineringshandling, og økte oktanen.
Raffineringsaksjonen til P4ENTEN10 Det skyldes hovedsakelig kondensasjonsreaksjoner (forening av forskjellige molekyler) og ikke av polymerisasjon (binding av like molekyler).
Kan tjene deg: natriumacetat: struktur, egenskaper, syntese, brukP4ENTEN10 Akselerer direkte alomatiske hydrokarboner med olefin hydrokarboner, olefinkonvertering til naftens og delvis polymerisasjon. Alkyleringsreaksjonen øker oktan antall bensin.
På denne måten oppnås en raffinert bensin av høy kvalitet.
 Noen oljederivater kan forbedres ved virkningen av P4ENTEN10 I sine molekyler. Forfatter: DRPeperscott230. Kilde: Pixabay.
Noen oljederivater kan forbedres ved virkningen av P4ENTEN10 I sine molekyler. Forfatter: DRPeperscott230. Kilde: Pixabay. I forskjellige applikasjoner
Fosforoksyd (V) tjener:
- Forbered fosforsyre H3Po4
- Få akrylat- og overflateaktive estere
- Forbered fosfatestere som brukes som flammehemmere, løsningsmidler og fortynningsmidler
- Fosfor Trikloridomdannelse til fosforoksyklorid
- Laboratory Reagent
- Produserer spesielle briller for vakuumrør
- Øk asfaltsmeltingspunktet
- Tjene som et standardmolekyl i bestemmelsen av fosfor eller fosfater i fosfatisk berg, gjødsel og Portland sement, i form av p2ENTEN5
- Forbedre koblingene mellom visse polymerer og elfenbenslaget som tennene har
 Noen spesielle glass som vakuumrør trenger å bruke P4ENTEN10 under produksjonen. Tvezymer [Public Domain]. Kilde: Wikimedia Commons.
Noen spesielle glass som vakuumrør trenger å bruke P4ENTEN10 under produksjonen. Tvezymer [Public Domain]. Kilde: Wikimedia Commons. Risiko
Fosforoksyd (V) må opprettholdes i forseglede beholdere og i friske, tørre og godt ventilerte steder.
Dette tjener til å forhindre at det ikke kan kontakte vann, da det kan reagere voldsomt med det, generere veldig varme, til det å brenne nærliggende materialer som er brennbare.
Fosforoksyd (V) Støv er irriterende øye- og luftveisanjeler og etsende for huden. Det kan produsere forbrenninger i øynene. Ved inntak forårsaker dødelig indre forbrenninger.
Referanser
- ELLER.S. National Library of Medicine. (2019). Fosforanhydrid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Nayler, p. (2001). Bitumen: modifisert. Kjemisk modifisering. I Encyclopedia of Materials: Science and Technology. Gjenopprettet fra Scientedirect.com.
- Malishev, f.W. (1936). Fosforpentoksid som et raffineringsmiddel for bensin. Industrial & Engineering Chemistry 1936, 28, 2, 190-193. Gjenopprettet fra puber.ACS.org.
- Epps, jr. OG.TIL. (1950). Fotometrisk bestemmelse av tilgjengelig fosforpentoksid i gjødslede. Analytisk kjemi 1950, 22, 8, 1062-1063. Gjenopprettet fra puber.ACS.org.
- Banerjee, a. et al. (1983). Bruk av fosforpentoksyd: forestring av organiske syrer. J. Org. Chem. 1983, 48, 3108-3109. Gjenopprettet fra puber.ACS.org.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Kirk-Ohmer (1994). Encyclopedia of Chemical Technology. Fjerde utgave. John Wiley & Sons.
- Ogliari, f.TIL. et al. (2008). Syntese av fosfatmonomerer og binding til dentin: esterifiseringsmetoder og bruk av fosforpentoksid. Journal of Dentistry, bind 36, utgave 3, mars 2008, side 171-177. Gjenopprettet fra Scientedirect.com.
- « Aluminiumacetat (Al (CH3CO) 3) Struktur, egenskaper, bruk
- Notasjon utviklet det som er, eksempler og øvelser »

