Grunnleggende oksider

- 1145
- 296
- Dr. Andreas Hopland
Vi forklarer hva de grunnleggende oksydene er, hvordan deres egenskaper, nomenklatur og gir flere eksempler er dannet,
 Mange grunnleggende oksider har slående, karakteristisk for metallfarger
Mange grunnleggende oksider har slående, karakteristisk for metallfarger Hva er grunnleggende oksider?
De Grunnleggende oksider De er uorganiske forbindelser som dannes av foreningen mellom oksygen og et metall. De kalles grunnleggende oksider fordi de produserer alkaliske eller grunnleggende løsninger når de oppløses i vann. Også fordi de reagerer med syrer for å danne et salt og vann gjennom en syre-base-nøytraliseringsreaksjon.
Grunnleggende oksider er veldig vanlige. Faktisk finnes de fleste metaller i naturen i oksydjord, så de pleide å bli kalt land.
Grunnleggende oksider er av stor betydning for industrien. Mange fargede pigmenter som brukes i bransjen er oksider. Andre oksider brukes som base for malerier, spesielt titan-, bly- og sinkoksider.
Grunnleggende oksydegenskaper
De er binære forbindelser
Disse forbindelsene dannes bare av to elementer: oksygen og et metall. Derfor er de binære forbindelser.
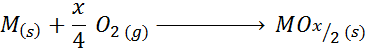
Dens empiriske formel er m2ENTENX eller moX/2
Valensen av oksygen i oksider er alltid -2, så de empiriske formlene for oksydene blir forenklet når metall Valencia er et momentnummer. Det samme skjer imidlertid ikke når det er rart.
For eksempel er den empiriske formelen for natriumoksyd NA2Eller fordi natrium har Valencia +1 (merkelig). I stedet er den empiriske formelen for kalsiumoksyd CaO, siden kalsium har Valencia +2.
De er uorganiske forbindelser, nesten alltid ioniske
De fleste grunnleggende oksider er krystallinske ioniske forbindelser. Dette inkluderer oksydene til alle alkaliske metaller, av alle alkalinere (bortsett fra beryllium) og den første serien av overgangsmetaller.
Kan tjene deg: kjemisk bindingDe har veldig høye fusjons- og kokepunkter
Den ioniske bindingen holder alle ioner som danner grunnleggende oksider sterkt forenet. Dette gjør dem vanskelige å smelte og enda vanskeligere å fordampe. Av denne grunn har de veldig høye fusjons- og kokepunkter.
De er solide ved romtemperatur
På grunn av samme faktum å ha høye fusjonspunkter, er alle basiske oksider fast ved romtemperatur.
De er grunnleggende forbindelser
Årsaken til at de kalles grunnleggende oksider er nettopp på grunn av sine syre-baseegenskaper. Oksider med større ionisk karakter produserer grunnleggende løsninger når de oppløses i vann og reagerer også med syrer, nøytraliserer dem.
Det skal imidlertid bemerkes at ikke alle metalloksider er grunnleggende. Noen er nøytrale, andre syrer og annen amfotor.
De fleste er lite oppløselige eller uoppløselige i vann
Alle grunnleggende oksider er uoppløselige i vann, med unntak av alkaliske og bariummetalloksider. Imidlertid er de løselige i syreoppløsninger.
Hvordan er grunnleggende oksider?
Grunnleggende oksider kan dannes spontant når metaller blir utsatt for luftoksygen. Faktisk består korrosjonslag som dannes på overflaten av metaller av forskjellige grunnleggende oksider.
Metallet som er involvert, generelt er det et alkalisk, alkalisk metall eller et overgangsmetall.
Du kan skrive tre generelle reaksjoner for dannelse av oksider, avhengig av om metall Valencia er jevn eller rart:
For metaller med rare valenser:
Når metallet har merkelig valens, er den generelle reaksjonen av oksyddannelse:

For eksempel for dannelse av natriumoksyd, der natrium har Valencia +1, er reaksjonen:
Det kan tjene deg: fosfor: historie, egenskaper, struktur, innhenting, bruk
Et annet eksempel er dannelsen av jernoksid, der jern har oksidasjon eller Valencia +3. I dette tilfellet er reaksjonen:

For metaller med Valencia +2:
Når metallet har Valencia +2, er den generelle reaksjonen av oksyddannelse:

For eksempel, i tilfelle av kalsiumoksyddannelse, der kalsium har Valencia +2, er reaksjonen:

For metaller med andre par:
Når metallet har til og med valenser i tillegg til +2, er den generelle reaksjonen av oksyddannelse:
Et eksempel på denne saken er titanoksyddannelsesreaksjonen (IV):

Grunnleggende oksider -nomenklatur
Det er tre nomenklatursystemer for de grunnleggende oksydene som er: den tradisjonelle nomenklaturen, bestanden og det systematiske.
For å nevne et oksid i henhold til de to første nomenklatursystemene er det nødvendig å kjenne metall Valencia, mens for siste.
Tradisjonell nomenklatur
I henhold til den tradisjonelle nomenklaturen er grunnleggende oksider navngitt fra og med ordet entenXido etterfulgt av kationnavnet. Dette etternavnet er bygget ved å plassere roten til metallnavnet og et system med prefikser og suffikser indikert av metall Valencia:
Oksid + Prefiks-raí-sufijo
Reglene for tildeling av prefikser og suffikser er oppsummert i følgende tabell:
Antall mulige valenser | Valencia | Prefiks | Suffiks |
1 enkelt Valencia | |||
Bare | --- | ___ico | |
2 Valencias | |||
Eldre | --- | ___ico | |
Liten | --- | ___Bjørn | |
3 Valences | |||
Eldre | --- | ___ico | |
Mellomprodukt | --- | ___Bjørn | |
Liten | Hikke___ | ___Bjørn | |
4 Valences | |||
Eldre | Per___ | ___ico | |
Major mellomliggende | --- | ___ico | |
Mindre mellomliggende | --- | ___ico | |
Liten | Hikke___ | ___ico |
Eksempel:
Han Tro2ENTEN3 Det er et jernoksid med Valencia +3. Jern har bare to valenser som er +2 og +3, så i dette oksydet har jernet det eldste av to valens. Av denne grunn blir suffikset lagt til ___ico i roten til navnet på jernmetallet som er Ferr-.
Det kan tjene deg: Ingen elektrolytter: Kjennetegn og eksemplerDerfor det tradisjonelle navnet på Tro2ENTEN3 er: Jern oksid.
Lager nomenklatur
I dette systemet er navnet bygget med ordene oksid av, etterfulgt av metallnavn. Til slutt er hans Valencia plassert i romertall i parenteser:
Metall + navnoksid (Valencia)
I tilfelle metallet bare har en valens, er det utelatt.
Eksempel:
I Cr2ENTEN3 Chromium har Valencia +3, så navnelageret er Kromoksid (III).
Systematisk nomenklatur
Dette er den eneste av de tre nomenklatørene som ikke spesifiserer metall Valencia. Sitematiske navn indikerer hvor mange oksygen- og metallatomer som inneholder forbindelsen ved bruk av numeriske prefikser.
Navnet er bygget med ordet oksid gitt av ham Prefiks som indikerer antall oksygen, Deretter artikkelen av etterfulgt av Metallnavn med sitt respektive prefiks.
Prefiks-oksyd + av + prefiks-metall
Noen prefikser er:
Antall | Prefiks |
1 | Bolle |
2 | Ga |
3 | Tri |
4 | Tetra |
5 | Penta .. |
Eksempel:
I den systematiske nomenklaturen, CR2ENTEN3 Det kalles dikrometrioksid, siden det har tre oksygen og to kromoer.
Eksempler på grunnleggende oksider
- Natriumoksid - Na2ENTEN
- Ferric Oxide - Tro2ENTEN3
- Jernmonoksid - stygt
- Cromic Oxide - CR2ENTEN3
- Divanadio pentaoxide - v2ENTEN5
- Kaliumoksid - K2ENTEN
- Bariumoksid - bao

