Bly jodstruktur, egenskaper, innhenting, bruk

- 1840
- 527
- Prof. Joakim Johansen
Han Bly jodid Det er en uorganisk forbindelse dannet av blyelementet (PB) i sin oksidasjon +2 og jod (I) med Valencia -1. Den kjemiske formelen er BNP2. Det er en giftig forbindelse. Fordi det fører er skadelig for mennesker, dyr og naturlige økosystemer. I tillegg kan jodid også forårsake noen sykdommer.
BNP -forbindelsen4, Dette er, med bly i oksidasjon +4, ser det ut til at det ikke eksisterer, sannsynligvis på grunn av reduksjonskapasiteten til jodidionen (i-). BNP2 Det er en solid gul farge som er lite oppløselig i vann.
 Bly jodid (BNP2) fast. W. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons.
Bly jodid (BNP2) fast. W. Oelen/CC By-SA (https: // CreativeCommons.Org/lisenser/by-SA/3.0). Kilde: Wikimedia Commons. Det kan oppnås ved bruk av en ionebyttereaksjon mellom et jodidsalt og en bly som begge er oppløselige i vann.
Den har halvlederegenskaper, så de fleste av de nåværende applikasjonene er i solcelleanordninger, detektorer av visse stråling og sensorer.
En av de mest studerte bruksområdene for denne forbindelsen er Perovskita solceller, som har vist seg å være veldig effektiv og lave kostnader.
[TOC]
Struktur
I blyjodid er foreningen mellom atomene bare ionisk delvis. Atomer danner lag med sekskantet struktur, og de er knyttet til hverandre gjennom svake krefter av van der Waals.
Disse kreftene er verken ioniske eller kovalente, er svake interaksjoner mellom de elektroniske lagene av atomer.
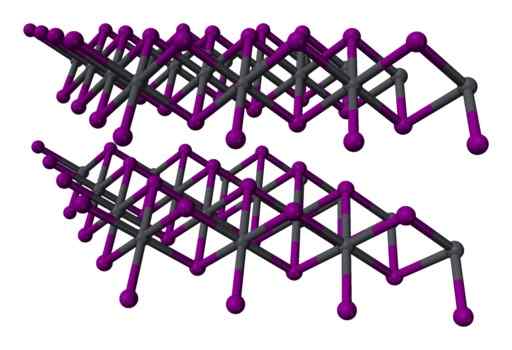 To -lagre tre -lagers struktur2 krystallinsk. Grå = bly; Fiolett = jod. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons.
To -lagre tre -lagers struktur2 krystallinsk. Grå = bly; Fiolett = jod. Benjah-BMM27 / Public Domain. Kilde: Wikimedia Commons. Nomenklatur
- Bly jodid
- Bly jodid (ii)
- Led Diyoduro
- Plumboso -jodid
Egenskaper
Fysisk tilstand
Lys gul krystallinsk faststoff. Sekskantede krystaller.
 Sekskantede krystaller av blyjodid. Alessandro E Damiano/CC av (https: // CreativeCommons.Org/lisenser/av/4.0). Kilde: Wikimedia Commons.
Sekskantede krystaller av blyjodid. Alessandro E Damiano/CC av (https: // CreativeCommons.Org/lisenser/av/4.0). Kilde: Wikimedia Commons. Molekylær vekt
461 g/mol
Smeltepunkt
410 ºC
Kokepunkt
954 ° C, koke med nedbrytning.
Tetthet
6.16 g/cm3
Løselighet
Lett vannløselig: 0,076 g/100 ml ved 25 ° C. Varmt vannløselig. Uoppløselig i alkohol og kald saltsyre (HCl).
Kan tjene deg: natrium: historie, struktur, egenskaper, risikoer og brukKjemiske egenskaper
Dets oksiderende og reduserende egenskaper er svake. Imidlertid kan du presentere okssidenuksjonsreaksjoner.
Selv om det er veldig lite oppløselig i vann, oppløses i konsentrerte oppløsninger av alkaliske jodider som kaliumjodid (KI). Det er løselig i konsentrert løsning av natriumacetat (CH3Lomme). Det oppløses fritt i natriumtiosulfatoppløsning (Na2S2ENTEN3).
Noen forfattere indikerer at i vann kan pbi genereres+ Og hvis det er overflødig ion (i-) mer komplekse arter som BNP kan dannes3- og BNP42-, blant andre.
Det er ikke brannfarlig.
Andre fysiske egenskaper
Det oppfører seg som en halvleder, det vil si at den kan eller ikke utføre strøm avhengig av forholdene den blir utsatt.
Det er en direkte gap -halvleder, det vil si at en av elektronene skal passere fra Valencia -båndet til kjøring, det må bare ha en mengde energi som tilsvarer den forbudte båndbredden.
På grunn av det høye atomnummeret av elementene (PB = 82, i = 53) har det en høy fotoelektrisk kapasitet. Det 2,5 noensinne gapbåndet tillater fotovoltaiske forestillinger med høy effektivitet ved temperaturer opp til 250 ° C.
Å skaffe
Det kan fremstilles ved å reagere en vannløselig forbindelse med iarhydinsyre (HI) eller med et oppløselig metalljodid. For eksempel blandes en vandig løsning av blyacetat med kaliumjodid:
PB (kap3Coo)2 + 2 ki → BNP2↓ + 2 k (velg3Coo)
Denne typen reaksjoner er kjent som "ionutveksling" fordi kationer og anioner utveksles mellom salter.
I det nevnte eksemplet er kaliumacetat veldig løselig i vann og forblir oppløst, mens kaliumjodid, er mindre løselig, bunnfall og filter. Rensing gjøres ved å omkrystallisere forbindelsen i vann.
Kan tjene deg: krystalliseringPBI nedbør2 Det kan sees i følgende bilde som viser et testrør der blynitrat (II) (PB (nei3)2) og kaliumjodid (ki) i vandig løsning. Denne effekten kalles "gull av gull".
 Regn av gull fra BNP2. Stefano SCT/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons.
Regn av gull fra BNP2. Stefano SCT/CC BY-S (https: // CreativeCommons.Org/lisenser/by-SA/4.0). Kilde: Wikimedia Commons. applikasjoner
Som halvleder
Det brukes som en detektor for høye -energi -fotoner som x -strål og gammastråler. Det kan brukes i fotovoltaiske enheter, fotoceller, LED -lys, optiske detektorer og i biologisk klassifisering og sensorer.
Hvis den introduseres i nanostrukturer, kan den brukes i fotokatalyse og solceller. I tillegg er mange BNP -nanopartikler2 De har selvlysende egenskaper.
 Blyjodid brukes i x -ray medisinske detektorer. Forfatter: Lkcjjang40090. Kilde: Pixabay.
Blyjodid brukes i x -ray medisinske detektorer. Forfatter: Lkcjjang40090. Kilde: Pixabay. Solceller
BNP2 Det er en mellomledd i syntesen av perovskitas bestemt for solceller. Denne typen fotovoltaiske celler inneholder metylammonium og blyjodid (velg3NH3BNP3) På grunnlag av onkel2.
Slike enheter har høy effektivitet og lave kostnader, så de har vært mye studier og forskning.
 Solceller på taket av et hus i åkeren. Solcellene der PBI brukes2 De er veldig effektive og er ikke veldig dyre, så de kan brukes i hus i fremtiden. Forfatter: Manfred Antranias Zimmer. Kilde: Pixabay.
Solceller på taket av et hus i åkeren. Solcellene der PBI brukes2 De er veldig effektive og er ikke veldig dyre, så de kan brukes i hus i fremtiden. Forfatter: Manfred Antranias Zimmer. Kilde: Pixabay. Siden Cho3NH3BNP3 Det kan bryte sammen med regnvann, det har blitt studert hvor forurensende disse cellene kan være begge når de er i bruk og når de kastes.
Ch3NH3BNP3 Ved kontakt med vann brytes det inn i metylamin (velg3NH2), Yodhydrric Acid og BNP2. Det siste, selv om det er lite oppløselig i vann, kan over tid frigjøre mengder fra den giftige ionen Pb2+.
Studiene er ikke avgjørende, fordi stedet der blyfrigjøring oppstår for å avgjøre om mengden kan være skadelig på kort sikt. På den annen side kan en fortsatt utgivelse bioakkumulere og være veldig farlig.
Kan tjene deg: Butanone: Struktur, egenskaper og brukAndre apper
- Det blir sådd i form av spray i skyene for å produsere regn.
- I filtre for astronomi av den fjerne infrarøde.
- I fotografering, inntrykk, filmer for å spille inn optiske bilder, fotografiske emulsjoner.
- I bremsebelegg. I smørefett.
- Kvikksølvdampbue lamper. På elektrotisk papir.
- Termoelektriske materialer, termiske batterier med jod.
Risiko
For sikkerhet
Det må lagres langt fra oksidanter som peroksider, peroksider, permanganater, kloriser og nitrater. Kontakt med kjemisk aktive metaller som kalium, natrium, magnesium og sink bør også unngås. I alle disse tilfellene kan en voldelig reaksjon oppstå.
Hvis du gjennomgår oppvarming, genereres giftige gasser og jod.
Til helse
Er veldig skadelig for mennesket. Det er bekreftet at det er kreftfremkallende for dyr, derfor er det rimelig trukket ut at det også er for mennesket.
Det kan forårsake hodepine, irritabilitet, redusere hukommelsen og forstyrre søvn. Bly som er inneholdt i denne forbindelsen kan generere permanent skade på nyrer, hjerne, nerver, blodceller og høytrykksrisiko.
Det må håndteres som en teratogen (forbindelse som kan generere en medfødt defekt). Det kan også produsere jodisme, hvis symptomer er overbelastning av neseborene, hodepine, irritasjon av slimhinne og kutanutbrudd, blant andre.
For det naturlige miljøet
Det er klassifisert som giftig forurensende. Det må holdes borte fra vann- og avløpskilder. For å unngå forurensende diker bør bygges når det er nødvendig å beholde den.
Det er veldig giftig for vannlevende liv med effekter som varer over tid, ettersom det er bioakumulerbart.
Referanser
- Bly, d.R. (Editor) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- ELLER.S. National Library of Medicine. (2019). Bly jodid. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov.
- Bomull, f. Albert og Wilkinson, Geoffrey. (1980). Avansert uorganisk kjemi. Fjerde utgave. John Wiley & Sons.
- Evstropiev; S.K. et al. (2020). Syntese og karakterisering av PVP/PBI2. Adv Compos Hybrid Mater 3, 49-57 (2020). Lenke gjenopprettet.Springer.com.
- Ismail, r.TIL. et al. (2016). Syntese av PBI2 Nanopartikler ved laserablasjon i metanol. J Mater Sci: Mater Electron 27, 10696-10700 (2016). Lenke gjenopprettet.Springer.com.
- Materialer. (2013). Bly jodid (BNP2) Halvleder. Gjenopprettet fra Azom.com.
- CDH (2008). Bly (ii) Jodid. Sikkerhetsdatabladmateriale. Gjenopprettet fra chdfinechemical.com.
- Hailegnaw, f. et al. (2015). Regn på metylammonium fører jodbaserte perovskitter: mulige miljøeffekter av perovskitt solceller. J. Phys. Chem. Lett. 2015, 6, 9, 1543-1547. Gjenopprettet fra puber.ACS.org.
- Wikimedia Foundation (2020). Bly (ii) Jodid. Innhentet fra.Wikipedia.org.
- « Blyacetatstruktur, egenskaper, innhenting, bruk
- Organisering av et objektivt selskap, struktur, eksempel »

