Silver Bromuro (AGBR) struktur, egenskaper og bruk
- 3027
- 881
- Prof. Oskar Aas
Han Sølvbromid Det er et uorganisk salt hvis kjemiske formel er AGBR. Dets faste stoffer består av Ag -kationer+ Og br aniss- i en andel 1: 1, tiltrukket av elektrostatiske krefter eller av ioniske koblinger. Det kan sees som om metallsølvet hadde gitt en av sine valenselektroner til molekylær brom.
Hans natur ligner hans "brødre" klorid og sølv yoduro. De tre saltene er uoppløselige i vann, de har lignende farger, og i tillegg er de følsomme for lys; det vil si at de lider fotokjemiske reaksjoner. Denne egenskapen har blitt brukt til å skaffe fotografier, resultatet av reduksjon av Ag -ioner+ til metall sølv.
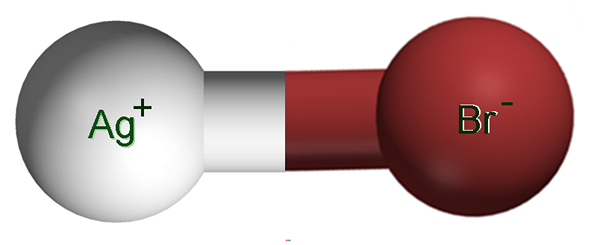
 Sølvbromidioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Sølvbromidioner. Kilde: Claudio Pistilli [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] I det øvre bildet vises et AG ionisk par+Br-, der de hvite og brune kulene tilsvarer Ag -ionene+ og Br-, henholdsvis. Her representerer de den ioniske bindingen som AG-BR, men det er nødvendig å indikere at det ikke er noen slik kovalent binding mellom begge ionene.
Det kan virke motstridende at sølv er den som gir den svarte fargen på de fargeløse fotografiene. Dette er fordi AGBR reagerer med lyset, og genererer et latent bilde; Noe som deretter intensiveres ved å øke sølvreduksjonen.
[TOC]
Sølvbromidstruktur
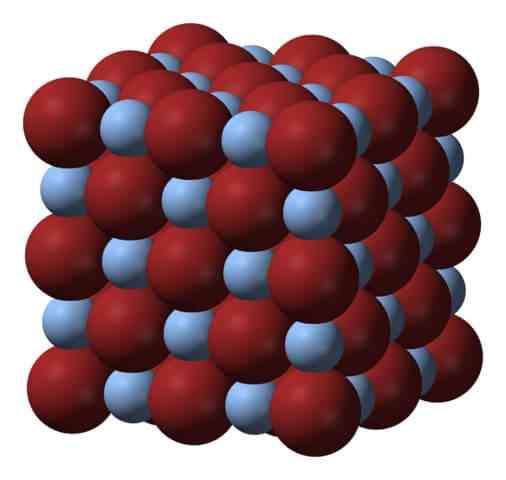 Krystallinsk struktur av sølvbromid. Kilde: Benjah-BMM27 via Wikipedia.
Krystallinsk struktur av sølvbromid. Kilde: Benjah-BMM27 via Wikipedia. Over nettverket eller krystallinsk struktur av sølvbromid. Her vises en mer trofast representasjon av størrelsesforskjellen mellom de ioniske radioene til Ag+ og Br-. Br anioner-, mer klumpete, la ikke mellomheter der Ag -kationer er lokalisert+, som er omgitt av seks BR- (og vice versa).
Denne strukturen er karakteristisk for et kubikk krystallinsk system, spesielt salttype; det samme, for eksempel at for natriumklorid, NaCl. Faktisk letter bildet dette ved å ha en perfekt kubikkgrense.
Kan tjene deg: Referanseelektrode: Kjennetegn, funksjon, eksemplerVed første øyekast kan det bemerkes at det er en viss forskjell i størrelse mellom ioner. Dette, og kanskje de elektroniske egenskapene til AG+ (og av mulig effekt av noen urenheter), fører det til AGBR -krystaller som presenterer feil; Det vil si at steder der ion bestillingssekvens i rommet er "pauser".
Krystallinske defekter
Disse feilene består av hull som er igjen av fraværende eller fordrevne ioner av sted. For eksempel blant seks br anioner- Normalt bør være CRURPRION AG+; Men i stedet kan det være et vakuum fordi sølv har flyttet til et annet interstitium (Frenkel -defekt).
Selv om de påvirker det krystallinske nettverket, favoriserer de sølvreaksjoner med lys; Og jo større krystall eller klynge (kornstørrelse), jo større er antall feil, og derfor vil den være mer følsom for lys. På samme måte påvirker urenheter strukturen og denne egenskapen, spesielt de som kan reduseres med elektroner.
Som en konsekvens av sistnevnte krever AGBRs store krystaller lavere eksponering for lys for å redusere; det vil si at de er mer ønskelige for fotografiske formål.
Syntese
I laboratoriet kan du syntetisere sølvbromidet som blander en vandig løsning av sølvnitrat, agno3, Med natriumbromidsalt, nabab. Det første saltet bringer sølv, og det andre bromidet. Det som følger er en dobbel forskyvnings- eller metateseaksjon som kan representeres med den kjemiske ligningen nedenfor:
Agno3(aq) + nabab (er) => nano3(AQ) + AGBR (S)
Det kan tjene deg: natriumbromid (NABR)Merk at saltnitratsaltet, nano3, Det er løselig i vann, mens Agbr utfeller som et fast stoff med en svak gul farge. Deretter vaskes det faste stoffet og gjennomgår vakuum. I tillegg til NABB, kan KBR også brukes som kilde til bromuøse anioner.
På den annen side kan AGBR fås gjennom dets Bromirita -mineral og dens behørige rensingsprosesser.
Egenskaper
Utseende
Leirgult faststoff som ligner på en leire.
Molekylmasse
187,77 g/mol.
Tetthet
6.473 g/ml.
Smeltepunkt
432 ° C.
Kokepunkt
1502 ° C.
Vannløselighet
0,140 g/ml ved 20 ° C.
Brytningsindeks
2.253.
Varmekapasitet
270 J/kg · K.
Lysfølsomhet
Det ble sagt i forrige avsnitt at det i AGBR -krystaller er det som fremmer følsomheten til dette saltet i lys, siden de fanger elektronene som er dannet; Og i teorien forhindrer de dem i å reagere med andre arter i midten, for eksempel luftoksygen.
Elektronet frigjøres fra reaksjonen fra BR- Med et foton:
Br- + Hv => 1/2br2 + og-
Merk at det er en2, som vil farge det faste rødt hvis det ikke fjernes. Frigjorte elektroner reduserer Ag -kationer+, I mellomrestommene, metallisk sølv (noen ganger representert som AG0):
AG+ + og- => Ag
Så å ha nettlikningen:
AGBR => AG + 1/2BR2
Når de "første lagene" av metallsølv på overflaten dannes, sies det at det er et latent bilde, fremdeles usynlig for det menneskelige øyet. Dette bildet blir gjort millioner av ganger mer synlig hvis en annen kjemisk art (for eksempel hydrokinon og fenidon, i utviklingsprosessen) øker reduksjonen av AGBR -krystaller til metallisk sølv
Det kan tjene deg: Carbon 12: Nuclear Notation, History, Commentsapplikasjoner
 Svart og hvit lommeurfotografering. Kilde: Pexels.
Svart og hvit lommeurfotografering. Kilde: Pexels. Silver Bromide er den mest brukte av alle halogenider innen åpenbaring av fotografiske filmer. AGBR brukes på disse filmene, laget med celluloseacetat, suspendert i en gelé (fotografisk emulsjon), og i nærvær av 4- (metylering) fenolsulfat (metol) eller fenidon, og hydrokinon.
Med alle disse reagensene kan livet gis til det latente bildet; Fullfør og akselererer transformasjonen av ionisk til metall sølv. Men hvis du ikke fortsetter med visse omhu og erfaring, vil alt overflatesølv oksidere, og kontrasten mellom svart -hvitt -fargene vil ende.
Det er grunnen til at de er viktige på badene for arbeidsledighet, fiksering og vasking, av fotografiske filmer.
Det er kunstnere som leker med disse prosessene på en slik måte at de skaper grå nyanser, som beriker skjønnheten i bildet og deres egen arv; Og alt dette gjør, noen ganger kanskje uten å mistenke det, takket være kjemiske reaksjoner, hvis teoretiske grunnlag kan bli litt kompleks, og en lysfølsom AGBR og som markerer et utgangspunkt.
Referanser
- Wikipedia. (2019). Sølvbromid. Hentet fra: i.Wikipedia.org
- Michael w. Davidson . (13. november 2015). Polarized Light Digital Image Gallery: Silver Bromide. Olympus. Gjenopprettet fra: Micro.Magnet.FSU.Edu
- Crystran Ltd. (2012). Sølvbromid (AGBR). Gjenopprettet fra: Crystran.co.Storbritannia
- Lothar Duenkel, Juergen Eichler, Gerhard Ackermann og Claudia Schneeweiss. (29. juni 2004). Selvlagde sølv-bromidbaserte emulsjoner for brukere i holografi: produksjon, prosessering og anvendelse, proc. Spie 5290, Practical Holography XVIII: Materials and Applications; Doi: 10.1117/12.525035; https: // doi.org/10.1117/12.525035
- Alan G. Form. (1993). Uorganisk kjemi. (Andre utgave.). Redaksjon tilbake.
- Carlos Güido og Ma Eugenia Bautista. (2018). Introduksjon til fotografisk kjemi. Gjenopprettet fra: Fotografering.Ceduc.com.MX
- Garcia d. Vakker. (9. januar 2014). Kjemi, fotografering og Chema Madoz. Gjenopprettet fra: Dimetylsulfuro.er
- « Hvordan utdanne et barn tilstrekkelig 13 praktiske råd
- Syklobutanstruktur, egenskaper, bruksområder og syntese »

