Natriumkarbonat (Na2CO3)
- 3449
- 314
- Prof. Theodor Gran
Vi forklarer hva natriumkarbonat, dets fysiske og kjemiske egenskaper, struktur og anvendelser er
 Natriumkarbonatstruktur og formel
Natriumkarbonatstruktur og formel Hva er natriumkarbonat?
Han natriumkarbonat (Na2Co3) Det er et uorganisk salt, alkalisk metall og kullsyre. Han er også kjent over hele verden som Sosa Ash. Innsjøer og vulkanske aktiviteter beriket jordsmonnene i natrium, hvorav plantene ble næret; Så, etter en brann, sprer disse plantene karbonatasken.
Hvordan oppstår dette metalliske natriumsaltet? Den rene natrium har en Valencia -konfigurasjon [NE] 3S1. 3S orbital elektron1 Det er lett løsrevet av andre elementer av naturen (som svovel, oksygen, klor, fluor, etc.), dannende mineralforbindelser der det stabile ionen NA deltar+.
Deretter en+ Det er ledsaget av andre ioniske arter i disse faste stoffene; Av disse er natriumkarbonat bare en til stede i naturen. Siden den gang har det hatt bruk i alle sivilisasjoner gjennom tidene. Disse sivilisasjonene fant i det grå støvet gunstige egenskapene for sine hjem og mennesker.
Disse egenskapene markerte bruken av dem, som i dag opprettholder tradisjonelle aspekter av fortiden, og andre imøtekommer dagens behov.
Natriumkarbonat er veldig rikelig i naturen, og kanskje også i andre territorier utenfor planeten Jorden, for eksempel noen av månene i solsystemet.
Formel
Den kjemiske formelen for natriumkarbonat er NA2Co3. Hvordan tolkes det? Det betyr at, i det krystallinske faststoffet, for hver co -ion32- Det er to Na -ioner+.
Natriumkarbonatstruktur
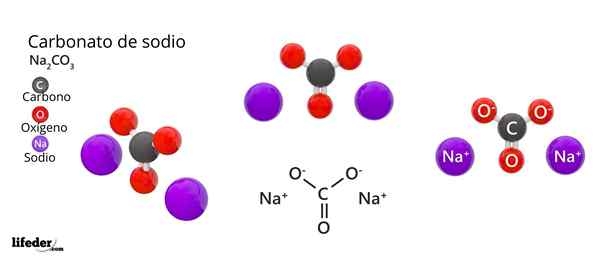
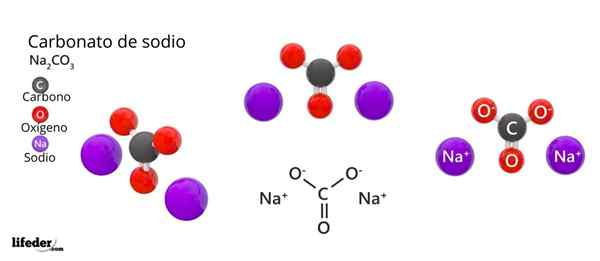
I det øvre bildet er strukturen til NA representert2Co3 Anhydrid (også kalt Sosa Calcinada). Lilla kuler tilsvarer Na -ioner+, mens svart og rødt til ionene co32-.
Karbonationer har en flat trigonal struktur, med oksygenatomer i toppunktene.
Det kan tjene deg: Kinaminsyre: Struktur, egenskaper, innhenting, brukBildet gir et panorama sett fra et høyere fly. Naioner+ De er omgitt av seks oksygenatomer, fra co -ions32-. Det vil si i na2Co3 Anhydrid Natriumet møter en oktaedrisk koordinasjonsgeometri (det er låst i sentrum av en oktaedron).
Imidlertid er denne strukturen også i stand til å huse vannmolekyler, og samhandle med hydrogenbroer med toppunktene til trekantene.
Faktisk hydrerer Na2Co3 (Na2Co3· 10H2Eller, na2Co3· 7H2Eller, na2Co3· H2Eller, og andre) er av større overflod enn anhydrid salt.
Termonatritt (na2Co3· H2O), Natron (na2Co3· 10H2O) og trona (na3(HCO3) (Co3) · 2H2Eller er de viktigste naturlige kildene til natriumkarbonat, spesielt Trona -mineralet, representert i det første bildet.
Bruker/applikasjoner av natriumkarbonat
Natriumkarbonat oppfyller mange funksjoner hos mennesker, husholdninger og industri, blant disse funksjonene Følgende skiller seg ut:
- Natriumkarbonat brukes i en rekke rengjøringsprodukter. Dette skyldes dens desinfiserende kapasitet, dens kraft til å oppløse fett og deres eiendom for å myke vann. Det er en del av vaskemidler som brukes i vaskerier, automatisk oppvaskmaskin, rent glass, flekker omrøring, blekere osv.
- Karbonat desinfeksjonsmiddel kan brukes på ikke -harde overflater, for eksempel gulv, vegger, porselen og badekar, med unntak av Fiberfiber og aluminium, som kan riper av ham.
- Det brukes i noen matvarer for å unngå koppen som kan oppstå i disse.
- Det er til stede i flere personlige pleieprodukter, for eksempel boblebad, tannpasta og såper.
- Det brukes i glassindustrien på grunn av dens evne til å bryte ned silikater.
- Det brukes til å opprettholde svømmebassengene, der det oppfyller en desinfeksjonsmiddel og reguleringsfunksjon av pH.
- Hos mennesker brukes terapeutisk i behandling av surhet og dermatitt.
- I veterinærmedisin brukes det i behandlingen av ringorm og hudrensing.
Natriumkarbonatsyntese

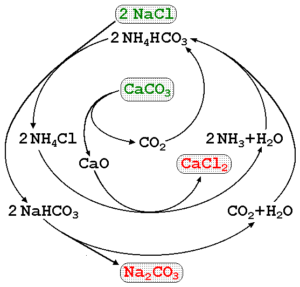
Natriumkarbonat kan produseres ved hjelp av saltlake av hav og kalkstein (Caco3) I solvayprosessen. I det overlegne bildet illustreres et prosessdiagram på å peke ut produksjonsrutene, så vel som reagensene, mellommennene og produktene. Reagensene er skrevet med grønne bokstaver, og produktene med røde bokstaver.
Overvåking av disse reaksjonene kan være litt intrikat, men den globale ligningen som bare indikerer reagensene og produktene er:
2NaCl (aq) + Caco3(S) Na2Co3(S) + CACL2(AC)
Caco3 Den har en veldig stabil krystallinsk struktur, så den krever stadig mye energi til å dekomponere den i CO2. I tillegg genererer denne prosessen store mengder CACL2 (Kalsiumklorid) og andre urenheter, hvis utslipp påvirker kvaliteten på vann og miljø.
Det er også andre metoder for natriumkarbonatproduksjon i industrielle felt, for eksempel Hou og LeBlanc -prosesser.
I dag er det å hente fra sine naturlige mineraler bærekraftig, og trona er den mest tallrike av disse.
På den annen side besto den mest tradisjonelle metoden av dyrking og forbrenning av planter og alger rik på natrium. Deretter ble asken badet med vann og utsatt for oppvarming til produktet. Herfra dukket Sosas berømte aske.
Natriumkarbonategenskaper
Deretter en2Co3 Det er et hygroskopisk hvitt fast stoff, toalett, med en molekylvekt på 106 g/mol og en tetthet på 2,54 g/ml ved 25 ° C.
Egenskapene endres etter hvert som et vannmolekyl inkorporerer i sin krystallinske struktur. Ettersom vann kan danne hydrogenbroer og ionene "åpent rom" mellom dem, øker volumet på glasset og tettheten av hydratet reduseres. For eksempel for na2Co3· 10H2Eller, dens tetthet er 1,46 g/ml.
Kan tjene deg: Reversibel reaksjon: Kjennetegn og eksemplerDeretter en2Co3 smelter ved 851 ºC, nedbryter i henhold til følgende ligning:
Na2Co3(S) => na2Eller (s) + co2(g)
Igjen, til tross for co -ionene32- og na+ De er forskjellige i størrelser, deres elektrostatiske interaksjoner er veldig effektive og opprettholder et stabilt krystallinsk nettverk.
Vannmolekyler "hindrer" disse interaksjonene, og som et resultat er hydrater mer utsatt for nedbrytning enn anhydrid.
Det er et grunnleggende salt; det vil si oppløst i vann genererer en løsning med en pH større enn 7. Dette skyldes hydrolyse av CO32-, hvis reaksjon slipper Oh- i midten:
Co32-(AC) + H2Eller (l) HCO3-(AC) + OH-(AC)
Det er veldig løselig i vann og polare løsningsmidler, som glyserol, glyserin, aceton, acetater og flytende ammoniakk.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. I gruppe 1 -elementer. (Fjerde utgave., p. 265). Mc Graw Hill.
- Scifun.org. (2018). Natriumhydrogenkarbonat og natriumkarbonat. Gjenopprettet fra Scifun.org
- Wikipedia. (2018). Natriumkarbonat. Innhentet fra.Wikipedia.org
- Pubchem. (2018). Natriumkarbonat. Gjenopprettet fra Pubchem.NCBI.NLM.NIH.Gov
- Ciner Resources Corporation. (2018). Soda aske. Ciner kom seg.oss.com
- Peltier k. (3. juli 2018). Alt du trenger å vite om natriumkarbonitt. Hentet 8. april 2018, fra: Thespruce.com
- Nettbransjer. (2018). Natriumkarbonat - bruk av natriumkarbonat. Hentet 8. april 2018, fra: Science.Jank.org

