Forskjeller mellom organiske og uorganiske forbindelser

- 2503
- 515
- Dr. Andreas Hopland
De Forskjeller mellom organiske og uorganiske forbindelser De er ikke alltid enkle, og adlyder heller ikke en uforanderlig regel, fordi det når det gjelder kjemi det er symfiner med unntak som motsier eller stiller spørsmål ved tidligere kunnskap. Imidlertid er det egenskaper som gjør det mulig å skille mellom mange forbindelser som eller ikke uorganiske.
Per definisjon er organisk kjemi studien som inkluderer alle grener av karbonkjemi; Derfor er det logisk å tro at skjelettene deres er sammensatt av karbonatomer. På den annen side består uorganiske skjeletter (uten å gå inn i polymerer) vanligvis av noe annet element i det periodiske bordet annet enn karbon.
Levende vesener, på alle sine skalaer og uttrykk, er praktisk talt laget av karbon og andre heteroátomos (h, o, n, p, s, etc.). Så alt det grønne som dekker jordskorpen, så vel som skapningene som går på den, er levende eksempler på blandede organiske forbindelser kompleks og dynamisk.
På den annen side, borer jorden og i fjellet, finner vi rike minerallegemer i sammensetning og geometriske former, som i deres aller fleste er uorganiske forbindelser. Sistnevnte definerer også nesten helt atmosfæren vi puster, og havene, elver og innsjøer.
Organiske forbindelser | Uorganiske forbindelser | |
Atomer som komponerer det | De inneholder karbonatomer. | De består av andre elementer enn karbon. |
De er en del av .. | Er en del av levende vesener. | De er en del av inerte vesener. |
Kilder der de er | De er mindre rikelig i naturlige kilder. | De er rikere i naturlige kilder. |
Typer forbindelser | De er vanligvis molekylære. | De er vanligvis ioniske. |
Typer lenker | Kovalente lenker. | Ioniske lenker. |
Molmasser | Større molmasser. | Nedre molmasser. |
Mangfold | De er mindre forskjellige. | De er mer forskjellige elementer. |
Fusjons- og kokepunkter | Mindre fusjons- og kokepunkter. | Høyere fusjons- og kokepunkter. |
Hovedforskjeller mellom organiske og uorganiske forbindelser
Uorganiske forbindelser oppnås fra naturlige kilder rikere enn av uorganiske forbindelser
 Sukkerkrystaller (høyre) og salt (til venstre) sett i mikroskop. Kilde: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)]
Sukkerkrystaller (høyre) og salt (til venstre) sett i mikroskop. Kilde: Oleg Panichev [CC BY-SA 4.0 (https: // creativecommons.Org/lisenser/by-SA/4.0)] Selv om det kan være unntak, oppnås uorganiske forbindelser vanligvis fra naturlige kilder rikere enn for organiske forbindelser. Denne første forskjellen fører til en indirekte uttalelse: uorganiske forbindelser er rikere (på jorden og i kosmos) enn organiske forbindelser.
På et oljesettsted vil selvfølgelig hydrokarboner og relatert dominere dominere, som er organiske forbindelser.
Tilbake til seksjonen kan det nevnes på sukkersaltet som et eksempel. Sukkerkrystallene (mer robust og fasettert) og salt er vist ovenfor (mindre og avrundet).
Sukkeret oppnås, etter en serie prosesser, fra sukkerrørplantasjer (i solfylte eller tropiske regioner) og sukkerroer (i kalde regioner eller i begynnelsen av vintre eller høst). Begge er naturlige og fornybare råvarer, som dyrkes til riktig høst.
Kan tjene deg: Standardisering av løsningerI mellomtiden kommer salt fra en mye mer rikelig kilde: havet, eller innsjøer og salter som Halita Mineral (NaCl). Hvis all sukkerrør og sukkerroer ble samlet, kunne de aldri samsvare med de naturlige saltreservene.
Uorganiske krystaller er vanligvis ioniske mens organiske krystaller har en tendens til å være molekylære
Når vi tar sukker-eksalparet igjen som eksempel, vet vi at sukker består av et disakkarid kalt sukrose, som igjen går i oppløsning til en glukoseenhet og en annen av fruktose. Sukkerkrystallene er molekylære, siden de er definert av sukrose og deres intermolekylære hydrogenbroer.
I mellomtiden utgjør saltkrystaller et naionnettverk+ og cl-, som definerer en kubikkstruktur sentrert på ansiktene (FCC).
Det sentrale punktet er at uorganiske forbindelser vanligvis danner ioniske krystaller (eller i det minste, som har en høy ionisk karakter). Imidlertid er det flere unntak, for eksempel CO -krystaller2, H2S, så2 og andre uorganiske gasser, som stivner ved lave temperaturer og høyt trykk, og er også molekylær.
Vann representerer det viktigste unntaket fra dette punktet: is er en uorganisk og molekylær krystall.
 De få snøene eller isen er vannkrystaller, utmerkede eksempler på uorganiske molekylære krystaller. Kilde: Sieverschar de Pixabay.
De få snøene eller isen er vannkrystaller, utmerkede eksempler på uorganiske molekylære krystaller. Kilde: Sieverschar de Pixabay. Mineraler er i hovedsak uorganiske forbindelser, og krystaller er derfor overveiende ioniske i naturen. Det er grunnen til at dette andre punktet anses som gyldig for et bredt spekter av uorganiske forbindelser, inkludert salter, sulfider, oksider, telluros, etc.
Den typen lenke som styrer i organiske forbindelser er kovalent
Det samme sukker og saltkrystaller etterlater noe spørsmål: De førstnevnte inneholder kovalente (retningsbestemte) koblinger, mens sistnevnte viser ioniske (ikke -retning) koblinger (ikke -retning).
Dette punktet er direkte korrelert med det andre: en molekylær krystall må nødvendigvis ha flere kovalente bindinger (dele et par elektroner mellom to atomer).
Igjen etablerer organiske salter visse unntak, siden de også har en sterkt ionisk karakter; For eksempel natriumbenzoat (C6H5Pata) er et organisk salt, men innenfor benzoat og dens aromatiske ring er det kovalente bindinger. Likevel sies det at krystallene deres er ioniske gitt den elektrostatiske interaksjonen: C6H5COO- Na+.
I organiske forbindelser dominerer kovalente bindinger mellom karbonatomer
Eller hva er det samme å si: Organiske forbindelser består av kullsyreholdige skjeletter. I dem er det mer enn en C-C- eller C-H-binding, og dette skjelettet kan være lineært, drar eller forgrenet, varierende i graden av deres umettet og typen substituent (heteroaátomos eller funksjonelle grupper). I sukker, C-C, C-H og C-OH florerer.
Det kan tjene deg: redusere middel: konsept, de sterkeste, eksempleneLa oss som et eksempel Co, Ch2Och2 og h2C2ENTEN4. Hvilke av disse tre forbindelsene er uorganiske?
I kap2Och2 (Etylendioksid) Det er fire C-H-bindinger og to C-O-lenker, mens i H2C2ENTEN4 (oksalsyre) Det er en C-C, to C-OH og to C = O. Strukturen til h2C2ENTEN4 Det kan skrives som Hooc-COOH (to koblede karboksylgrupper). I mellomtiden består CO av et molekyl som vanligvis er representert med en hybridbinding mellom C = O og C≡O.
Siden det i CO (karbonmonoksid) bare er et karbonatom knyttet til et av oksygen, er denne gassen uorganisk; De andre forbindelsene er organiske.
Organiske forbindelser har vanligvis større molmasser
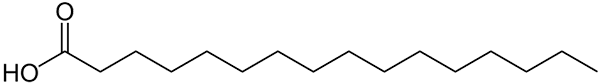 Struktur representert med palmitinsyrelinjer. Den store tingen som sammenlignes med mindre uorganiske forbindelser, eller formelvekten til saltene kan bli lagt merke til. Kilde: Wolfgang Schaefer [Public Domain]
Struktur representert med palmitinsyrelinjer. Den store tingen som sammenlignes med mindre uorganiske forbindelser, eller formelvekten til saltene kan bli lagt merke til. Kilde: Wolfgang Schaefer [Public Domain] Igjen er det mange unntak fra disse reglene, men vanligvis har organiske forbindelser en tendens til å ha større molmasser på grunn av deres kullsyreholdige skjelett.
For eksempel er jekslene til de ovennevnte forbindelser: 28 g/mol (CO), 90 g/mol (h2C2ENTEN4) og 60 g/mol (velg2Och2). Selvfølgelig CS2 (Karbondisulfid), Uorganisk forbindelse og hvis molmasse er 76 g/mol, "veier" mer enn Cho2Och2.
Men hva med fett eller fettsyrer? Av biomolekyler som DNA eller proteiner? Eller av omfattende lineære kjedehydrokarboner? Eller asfalten? Molmassene overstiger lett 100 g/mol. Palmitinsyre (øvre bilde) har for eksempel en 256 g/mol molar deig.
Organiske forbindelser er rikere i antall
Noen uorganiske forbindelser, kalt koordinasjonskomplekser, er tilstede Isomeía. Dette er imidlertid mindre mangfoldig sammenlignet med organisk isomeria.
Selv om vi tilsetter alle salter, oksider (metallisk og ikke -metallisk), sulfider, telururoer, karbider, hydrider, nitrider, etc., Vi ville ikke samle kanskje ikke engang halvparten av de organiske forbindelsene som kan eksistere i naturen. Derfor er organiske forbindelser rikere i antall og rikere i strukturer.
Uorganiske forbindelser er elementære mer mangfoldige
I henhold til elementært mangfold er imidlertid uorganiske forbindelser mer varierte. Fordi? Fordi du med den periodiske tabellen i hånden kan bygge hvilken som helst type uorganisk forbindelse; Mens en organisk forbindelse bare er begrenset til elementene: C, H, O, P, S, N og X (halogener).
Vi har mange metaller (alkaliske, alkaliner, overgang, lantanider, actinider, de fra blokk P) og uendelig til alternativer for å kombinere dem med flere anioner (vanlig uorganisk); Slik som: CO32- (Karbonater), CL- (Klorider), P3- (fosfuros), eller2- (oksider), oh- (hydroksider), så42- (sulfater), cn- (Cyanider), SCN- (Tiocianates), og mange flere.
Merk at CN -anioner- og SCN- De ser ut til å være organiske, men de er faktisk uorganiske. En annen forvirring er oksalatanionen, C2ENTEN42-, som er organisk og ikke -organisk.
Kan tjene deg: Diagonal regelUorganiske forbindelser har høyere fusjons- og kokepunkter
Igjen er det flere unntak fra denne regelen, siden alt avhenger av hvilket par forbindelser som blir sammenlignet. Imidlertid, som holder seg til uorganiske og organiske salter, har førstnevnte vanligvis større fusjons- og kokepunkter enn sistnevnte.
Her finner vi et annet implisitt punkt: Organiske salter er utsatt for nedbrytning, fordi varme bryter sine kovalente bindinger. Likevel sammenligner vi Calcium Tartrato PAR (CAC4H4ENTEN6) og kalsiumkarbonat (Caco3). CAC4H4ENTEN6 Den dekomponerer ved 600 ° C, mens Caco3 Det smelter ved 825 ° C.
Og at Caco3 er langt fra å være et av saltene med de høyeste smeltepunktene, som i tilfellene av CAC2 (2160 ºC) og CAS2 (2525 ºC): henholdsvis forgasser og kalsiumsulfid.
Organiske forbindelser er mer sjeldne i universet
De enkleste og mest primitive organiske forbindelsene, som metan, Cho4, Urea, CO (NH2)2, eller aminosyren glycina, NH2Ch2COOH, er svært sjeldne arter i kosmos sammenlignet med ammoniakk, karbondioksid, titanoksider, kull, etc. I universet blir ikke til og med forløpermaterialene i livet ofte oppdaget.
Organiske forbindelser støtter livet i mye større grad enn uorganisk
 Skallet til en Morrocoy består av en blanding av bein dekket av keratin, som er sammensatt av en uorganisk matrise (hydroksyapatitt og relaterte mineraler) og organisk (kollagen, brusk og nerver). Kilde: Morrocoy_ (geochelone_carbonary).JPG: Fotografiet.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)]
Skallet til en Morrocoy består av en blanding av bein dekket av keratin, som er sammensatt av en uorganisk matrise (hydroksyapatitt og relaterte mineraler) og organisk (kollagen, brusk og nerver). Kilde: Morrocoy_ (geochelone_carbonary).JPG: Fotografiet.0 (https: // creativecommons.Org/lisenser/by-SA/3.0)] Karbonkjemi, organisk, anvendt i forståelsen av metabolske prosesser, blir biokjemi (og fra synspunkt av metallkationer, i bioinorganisk).
Organiske forbindelser er hjørnesteinen i livet (for eksempel Morrocoy i det øvre bildet), takket være C-C-koblingene og det enorme konglomeratet av strukturer som følge av disse koblingene, og til dets interaksjon med krystaller av uorganiske salter.
Tilbake til sukkersaltparet er de naturlige kildene til sukker i live: de er avlinger som utvikler seg og dør; Men det skjer ikke det samme med kildene til saltet: havene eller saltvannsavsetningene er i live (i fysiologisk forstand).
Planter og dyr syntetiserer uendelige organiske forbindelser, som integrerer et omfattende utvalg av naturlige produkter (vitaminer, enzymer, hormoner, fett, fargestoffer, etc.).
Vi kan imidlertid ikke utelate det faktum at vann er livets løsningsmiddel (og er uorganisk); Heller ikke at oksygen er uunnværlig for cellulær respirasjon (uten å navngi metallkofaktorer, som ikke er uorganiske forbindelser, men kationer). Derfor spiller uorganisk også en avgjørende rolle i definisjonen av livet.
Referanser
- Shiver & Atkins. (2008). Uorganisk kjemi. (Fjerde utgave). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Kjemi. (8. utg.). Cengage Learning.
- Graham Solomons t.W., Craig f. Yngel. (2011). Organisk kjemi. Aminer. (10. utgave.). Wiley Plus.
- Helmestine, Anne Marie, PH.D. (3. juli 2019). Forskjellen mellom organisk og uorganisk. Gjenopprettet fra: Thoughtco.com
- Texas Education Agency. (2019). Organisk eller uorganisk? Gjenopprettet fra: Texasgateway.org
- Sukrose. (s.F.). Hvordan sukker lages: en introduksjon. Gjenopprettet fra: Sucrosa.com
- Wikipedia. (2019). Liste over uorganiske forbindelser. Hentet fra: i.Wikipedia.org
- « Forskjeller mellom hastighet og hastighet (med eksempler)
- 10 emosjonell intelligensdynamikk for barn og voksne »

